从含镁、钾盐湖水中蒸发最后得到产物中含光卤石(xKCl·yMgCl2·zH2O),它是制造钾肥和提取金属镁的重要原料,其组成可通过下列实验测定:
①准确称取5.550g样品溶于水,配成100.0mL溶液。
②将溶液分成二等份,在一份中加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干
燥至恒重,得到白色固体0.580g。
③在另一份溶液中加入足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥
至恒重,得到白色固体4.305g。
(1)步骤②中检验白色固体已洗净的方法是: 。
(2)已知某温度下Mg(OH)2的Ksp=6.4×l0−12,当溶液中c(Mg2+)≤1.0×10−5mol·L−1可视为沉淀完全,则此温度下应保持溶液中c(OH-)≥ mol·L−1。
(3)通过计算确定样品的组成(写出计算过程)。
粗盐中除含有Ca2+、Mg2+、SO42-等可溶性杂质外,还含有泥砂等不溶性杂质。
(1)检验溶液中含有SO42-的方法是。
(2)将粗盐溶解过滤除去不溶性杂质后,在滤液中依次滴加过量NaOH溶液、BaCl2溶液和Na2CO3溶液,直至不再产生沉淀。这些操作的目的是, 滴加Na2CO3溶液时发生反应的化学方程式为。
(3)用提纯后的NaCl固体配制100mL 1.0 mol/L NaCl溶液,所用仪器除托盘天平、烧杯、玻璃棒、药匙外,还需要 (填仪器名称)。转移溶液时没有洗涤烧杯会造成所配溶液浓度偏________(填“高”或“低”,下同);定容时仰视刻度线会造成所配溶液浓度偏________。
北京市规定食盐中碘含量标准为(18~33)mg/kg。为测定加碘食盐样品的碘含量,某实验小组设计了如下步骤:
Ⅰ.用天平准确称取5.0 g食盐样品,加适量蒸馏水使其完全溶解。
Ⅱ.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全。
Ⅲ.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液3.0 mL,恰好反应完全。
(1)步骤Ⅱ中反应后碘元素以形式(填物质的化学式)存在。
(2)已知步骤Ⅲ中S2O32-反应后转化为S4O62-,写出步骤Ⅲ的离子方程式。
(3)上述实验样品中碘含量是mg/kg。
现有含NaCl、Na2SO4、Na2CO3和NaHCO3的固体混合物。某同学为测定其中各组分的含量,取部分样品溶于水,并设计了如下实验流程(所加试剂均为过量,反应①~③均为复分解反应)。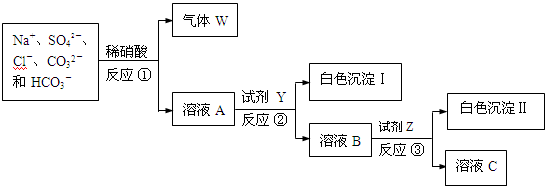
请回答: (1)气体W的化学式是。
(1)气体W的化学式是。
(2) 溶液A中主要存在的微粒除了Na+、SO42-、Cl-之外还有。
溶液A中主要存在的微粒除了Na+、SO42-、Cl-之外还有。
(3)反应②和③之后均需进行的操作的名称是。
(4)试剂Y是(填化学式)。
(5)测定各组分的含量,需要测的数据有:混合物总质量、白色沉淀Ⅰ和Ⅱ分别的质量和 。
有以下物质:①Mg②Al③C④稀硫酸⑤浓硫酸⑥NaOH溶液
(1)写出①与④反应的离子方程式。
(2)既能跟④又能跟⑥反应的是(填序号),写出它与⑥反应的化学方程式。
(3)写出写出③与⑤反应的化学方程式,下列关于该反应中⑤体现的性质说法正确的是。
a.既体现氧化性又体现酸性
b.只体现氧化性
c.只体现酸性
d.体现吸水性
现有下列4种物质:①SO2、②NO2、③FeCl2溶液、④NaHCO3溶液。其中,常温下为红棕色气体的是(填序号,下同);可使品红溶液褪色的是;焰色反应呈黄色的是;与氢氧化钠溶液反应,生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色的是。