物质(t-BuNO)2在正庚烷或CCl4中均可以发生反应:(t-BuNO)2 2(t-BuNO)。在20℃时,向2 L正庚烷中加入(t-BuNO)2 1.0 mol,10 min时反应达平衡,此时(t-BuNO)2的平衡转化率为75%(假设反应过程中溶液体积始终为2 L)。下列说法正确的是
2(t-BuNO)。在20℃时,向2 L正庚烷中加入(t-BuNO)2 1.0 mol,10 min时反应达平衡,此时(t-BuNO)2的平衡转化率为75%(假设反应过程中溶液体积始终为2 L)。下列说法正确的是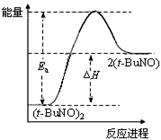
| A.反应在前10 min内的平均速率为ν(t-BuNO)=0.0375mol·L-1·min-1 |
| B.保持其他条件不变,若此时再向正庚烷反应体系中加入正庚烷,平衡向生成(t-BuNO)2的方向移动 |
| C.保持其他条件不变,升高温度,(t-BuNO)2的平衡转化率大于75%,则其能量关系可用右图表示 |
| D.保持其他条件不变,若该反应在CCl4中进行,其平衡常数为1.9,则(t-BuNO)2的平衡转化率大于75% |
若aAn+ 与 bB2— 两种离子的核外电子层结构相同,则a等于( )
| A.b+n-2 | B.b+n+2 | C.b-n-2 | D.b-n+2 |
某元素二价阴离子核外有18个电子,质量数为32,该元素原子的原子核中的中子数()
| A.12 | B.14 | C.16 | D.18 |
某元素原子最外电子层上只有两个电子,该元素()
| A.一定是金属元素 | B.一定是ⅡA族元素 |
| C.一定是过渡元素 | D.可能是金属元素也可能不是金属元素 |
从某微粒的原子结构示意图反映出()
| A.质子数和中子数 | B.中子数和电子数 |
| C.核电荷数和核外电子层排布的电子数 | D.质量数和核外电子层排布的电子数 |
关于下列各图的叙述,正确的是
A.甲表示1mol H2 (g)完全燃烧生成水蒸气吸收241.8 kJ热量
B.甲表示2 mol H2(g)所具有的能量一定比2 mol气态水所具有的能量多483.6 kJ
C.乙表示常温 下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同
温同浓度的NaA溶液的pH小于NaB溶液的pH
D.乙图中起始时HA的物质的量浓度大于HB