关注饮用水,保证人民的生活质量。回答下列两个问题:
(1)饮用水中的NO3—对人类健康会产生危害,为了降低饮用水中NO3—的浓度,可以在碱性条件下用铝粉将NO3—还原为N2,其化学方程式为:10 Al + 6 NaNO3 + 4 NaOH =" 10" NaAlO2 + 3 N2↑ + 2 H2O。
请回答下列问题:
①上述反应中_________元素的化合价升高,则该元素的原子____________(填“得到”或“失去”)电子。
②用“单线桥法”表示反应中电子转移的方向和数目:
10 Al + 6 NaNO3 + 4 NaOH =" 10" NaAlO2 + 3 N2↑ + 2 H2O
(2)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
①工业上将氯气通入石灰乳制取漂白粉,化学方程式是_________________________________。
②漂白粉的有效成分是(填化学式)____________________________。
③漂白粉溶于水后,受空气中的CO2作用,即产生漂白、杀菌作用,离子方程式为___________________。
(6分)水溶液中存在水的电离平衡。
(1)常温时,在稀溶液中c(H+)和c(OH-)的乘积总是等于。
(2)用“>”、“<”或“=”填空:碱性溶液中,c(H+)c(OH-),在常温时pH7。
(3)有下列几种溶液:
| A.NH3·H2O | B.CH3COONa | C.NH4Cl | D.NaHSO4 |
常温下呈酸性的溶液有(填序号)
用离子方程式或电离方程式表示这些溶液呈酸性的原因:___________________________________。
某研究性学习小组利用废旧铅蓄电池阴、阳极填充物------铅膏(含PbO、PbO2、PbSO4)制备电绝缘材料三盐基硫酸铅(3PbO•PbSO4•H2O),进行资源回收研究,设计实验流程如下:
(1)步骤①铅膏中PbSO4与Na2CO3溶液反应转化为PbCO3,说明溶解度:PbSO4(填“>”或“<”)PbCO3。
(2)步骤①中PbO2转化为PbCO3的离子方程式是(请配平此离子方程式):
(3)将步骤①和④的滤液合并,加入PH=7,再经过、冷却结晶、
、洗涤、干燥,可获得Na2SO4•10H2O晶体。
(4)若铅膏的质量为78g,步骤①中PbO2和PbSO4全部转化为PbCO3,且PbO未发生反应;步骤②中共收集到5.6LCO2(标准状态),步骤③中获得90.9 g PbSO4,则铅膏中PbO的质量分数为(假设流程中原料无损失)。
阿明洛芬(G)属于苯丙酸类抗炎药,镇痛效果优于布洛芬。下图是阿明洛芬的一条合成路线。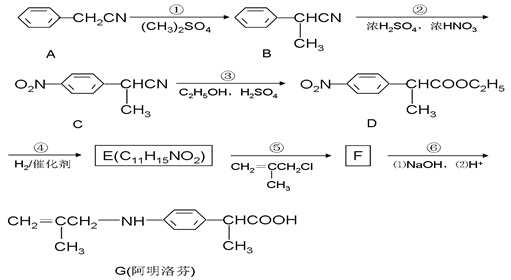
(1)E的结构简式为;②的反应类型:。
(2)D中含氧官能团的名称为、。
(3)反应③可以看成是两步反应的总反应,第一步是氰基(-CN)的完全水解反应生成羧基(-COOH),请写出第二步反应的化学方程式:。
(4)任意写出两种符合下列条件的E的同分异构体的结构简式、。
①能与FeCl3溶液发生显色反应②能发生水解反应,但不能发生银镜反应
③苯环上的取代基只有2种,且苯环上的核磁共振氢谱有两个吸收峰
(5)下列有关阿明洛芬(G)的说法正确的是()
| A.分子式为C13H17NO2 | B.属于氨基酸 |
| C.能与盐酸反应生成盐 | D.能发生取代、加聚、氧化、还原反应 |
Q、W、X、Y、Z均为元素周期表中前四周期元素,且其原子序数依次增大,Q元素的阳离子核外无电子,W元素原子的最外层电子数是其次外层电子数的2倍,Y是地壳中含量最多的元素,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
⑴W位于元素周期表第周期第族。Y的第一电离能(填“大于”或“小于”)X的第一电离能。
⑵XQ3分子中的化学键类型为(填“极性”或“非极性”)共价键,空间类型为。Q—X﹑Q—Y﹑Q—W中键长最短的是。
⑶Z的基态原子核外电子排布式是,Z的单质与X的最高价氧化物对应水化物的稀溶液反应的离子方程式为。
⑷已知:①WQ4(g) +4XY2(g) ﹦4XY(g)+WY2 (g)+2Q2Y(g)△H﹦-574KJ·mol-1
②WQ4(g) +4XY(g) ﹦2X2 (g) +WY2 (g) +2Q2Y(g)△H﹦-1160KJ·mol-1
则由WQ4还原XY2生成X2的热化学方程式为。
下表列出了①~⑩十种元素在周期表中的位置:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑩ |
|
| 4 |
⑨ |
⑴上述①~⑩十种元素中(用元素符号填空):
构成有机物的主要元素是 ,构成岩石与许多矿物的基本元素是 ,
化学性质最不活泼的元素 ,气态氢化物的水溶液呈碱性的元素 。
⑵上述①~⑨元素的最高价氧化物对应的水化物中:
碱性最强的物质的电子式为 ,酸性最强的物质的化学式为 。
⑶若以元素④和⑤的单质为电极,与元素③的最高价氧化物对应的水化物的水溶液组成原电池,则④的单质在此原电池中作______极(填“正”或“负”)
⑷元素⑦的某氧化物为有刺激性气味的无色气体,其氢化物为有臭鸡蛋气味的无色气体。若这两种气体混合,会生成一种淡黄色粉末。此反应化学方程式为 。若此反应中氧化产物的质量为3.2g,则反应中转移的电子数为 (填数值)。
⑸元素⑧和元素⑨两者核电荷数之差是 ,这两种元素中非金属性较弱的元素是 (填元素名称),能说明这两种元素的非金属性强弱的实验事实是(用离子方程式表示)
。