(12分)煤、天然气是社会生产、生活中重要的能源。
(1)工业上常把煤进行气化和液化处理,使煤变成清洁能源.煤气化和液化流程示意图如下: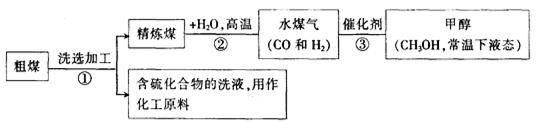
①已知H2、CO和CH3OH的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。写出由CO和H2合成甲醇的热化学方程式_________________
②煤进行气化和液化的优点是
(2) 天然气催化重整也可生成CO和H2
①500℃,向一体积可变的密闭容器中充入一定量CH4和水蒸气进行催化重整, 下列能说明反应一定处于平衡状态的是
| A.混合气体的密度不随时间变化 |
| B.CO和H2的体积分数之比不随时间变化 |
| C.v正(CH4)=3v逆(H2) |
| D.混合气体的平均相对分子质量不随时间变化 |
②CO和H2可用作燃料电池。一种熔融碳酸盐燃料电池原理示意如图: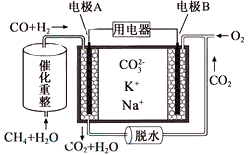
写出A电极反应式__________________
(3)CO一旦泄露会造成污染,环保检测中,有害气体的浓度常用1L有害气体的毫克值(mg/L)来表示,如对某气体样品中所含一氧化碳的浓度进行测定,其方法和实验步骤如下:
①首先将2.00L的气体样品通过盛有I2O5固体的加热管,反应后生成CO2和I2;
②用30.0mL 5.00×10-3mol/L的硫代硫酸钠溶液恰好吸收所产生的碘,发生的反应为:I2+2S2O32-=2I-+S4O62-
则样品中CO的浓度为
(14分)
 下表是元素周期表的一部分,请回答有关问题:
下表是元素周期表的一部分,请回答有关问题:
主族 周期 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 2 |
① |
② |
③ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
||||
| 4 |
⑨ |
④ |
⑩ |
 (1)表中化学性质最不活泼的元素,其原子结构示意图为。
(1)表中化学性质最不活泼的元素,其原子结构示意图为。 (2)表中能形成两性氢氧化物的元素是(用元素符号表示),写出该元素的
(2)表中能形成两性氢氧化物的元素是(用元素符号表示),写出该元素的 质与⑨最高价氧化物的水化物反应的化学方程式
质与⑨最高价氧化物的水化物反应的化学方程式 (3)④元素与⑦元素形成化合物的电子式
(3)④元素与⑦元素形成化合物的电子式 (4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 (填化学式)。
(填化学式)。 (5)③元素与⑩元素两者核电荷数之差是。
(5)③元素与⑩元素两者核电荷数之差是。 (6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表。
(6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表。


| 实验步骤 |
实验现象与结论 |
      |
(9分)
 某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:(1)请从下表中实验现象(Ⅱ)(填A、B、C……)中选出与方案(I)(填1、2、3……)对应的实验现象,填入答案(Ⅲ)中。
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:(1)请从下表中实验现象(Ⅱ)(填A、B、C……)中选出与方案(I)(填1、2、3……)对应的实验现象,填入答案(Ⅲ)中。

| 实验方案(I) |
实验现象(Ⅱ) |
答案(III) |
|
| 实验方案I |
实验现象II |
||
1.用砂纸擦后的镁带与沸 水反应,再向反应液中滴 水反应,再向反应液中滴 加酚酞 加酚酞 |
A浮与水面,剧烈反应,放出气体, 熔成—个小球,在水面上无定向移 熔成—个小球,在水面上无定向移 动,随之消失,溶液变红色。 动,随之消失,溶液变红色。 |
1 |
|
2.向新制的H2S饱和溶 液中滴加新制的氯水 液中滴加新制的氯水 |
B.产生大量气体,可在空气中燃 烧,溶液变成浅红色 烧,溶液变成浅红色 |
2 |
|
3.钠与滴有酚酞的冷水反应 |
C.反应不十分剧烈,产生的气体 可以在空气中燃烧 可以在空气中燃烧 |
3 |
|
4.镁带与2mol/L的盐酸 反应 反应 |
D.剧烈反应,产生的气体可以在 空气中燃烧 空气中燃烧 |
4 |
|
5铝条与2mol/L的盐酸 反应 反应 |
E.生成白色絮状沉淀,继而沉淀 消失 消失 |
5 |
|
6.向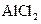 溶液中滴加 溶液中滴加 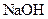 溶液至过量 溶液至过量 |
F.生成淡黄色沉淀 |
6 |
(2)通过以上实验分析了同周期元素的符号,从实验结果可以得出的结论是。
已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液: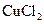 溶液、
溶液、 溶液、盐酸。按要求回答下列问题:
溶液、盐酸。按要求回答下列问题:
 (1)电工操作上规定:不能把铜导线和铝导线连接在一起使用。请说明原因
(1)电工操作上规定:不能把铜导线和铝导线连接在一起使用。请说明原因
 (2)若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池
(2)若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池 ,若能,请写出电极反应式,负极,正极。(若不能,后两空不填)
,若能,请写出电极反应式,负极,正极。(若不能,后两空不填)
 (3)设计一种以铁和硫酸反应为原理的原电池,要求画出装置图:(需标明电极材料及电池
(3)设计一种以铁和硫酸反应为原理的原电池,要求画出装置图:(需标明电极材料及电池 的正负。)
的正负。)
下列五种物质中,①Ar②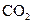 ③
③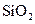 ⑤
⑤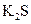 ,只存在共价键的是,只存在离子键的是,既存在离子键又存在共价键的是,不存在化学键的是。属于共价化合物的是属于离子化合物的是。
,只存在共价键的是,只存在离子键的是,既存在离子键又存在共价键的是,不存在化学键的是。属于共价化合物的是属于离子化合物的是。
下列反应中属于取代反应的是,属于加成反应的是。
①甲烷在光照下与氯气反应 ②乙烯使溴水褪色③乙烯使酸性高锰酸钾溶液褪色 ④苯与液溴反应 ⑤乙醇与乙酸酯化 ⑥苯与浓硝酸和浓硫酸的混酸反应