下列说法或表示方法中,正确的是
| A.等质量的硫蒸气和硫黄分别完全燃烧,前者放出的热量多 |
| B.a ℃、b kPa下,将0.5 mol O2和1.5 mol H2置于密闭容器中充分反应生成H2O(g),放热c kJ,其热化学方程式为2H2(g)+O2(g)=2H2O(g) ΔH=-2c kJ·mol-1 |
| C.常温常压下,2.8 g CO气体完全燃烧放出的热量为28.26 kJ,则表示CO燃烧热的热化学方程式为2CO(g)+O2(g)=2CO2(g) ΔH=-565.2 kJ·mol-1 |
| D.稀硫酸溶液与稀NaOH溶液反应的中和热为57.3 kJ·mol-1,则稀醋酸溶液与稀NaOH溶液反应的热化学方程式可表示为CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.3 kJ·mol-1 |
下列是某同学对相应的离子方程式所作的评价,其中评价合理的是
| 编号 |
化学反应 |
离子方程式 |
评价 |
| A |
碳酸钙与 醋酸反应 |
CO32-+2CH3COOH=CO2↑+H2O+2CH3COO- |
错误,碳酸钙是弱电解 质,不应写成离子形式 |
| B |
苯酚钠溶液中 通入CO2 |
2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
正确 |
| C |
NaHCO3的水解 |
HCO3-+H2O=CO32-+H3O+ |
错误,水解方程式 误写成电离方程式 |
| D |
等物质的量的FeBr2和Cl2反应 |
2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
错误,离子方程式中 Fe2+与Br-的物质的量 之比与化学式不符 |
某有机物的结构简式如图,下列关于该有机物的叙述正确的是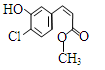
| A.该有机物的摩尔质量为200 |
| B.该有机物属于芳香烃 |
| C.该有机物可发生取代、加成、加聚、氧化、还原、消去反应 |
| D.1 mol该有机物在适当条件下,最多可与4mol NaOH和4mol H2反应 |
下列有关实验原理或实验操作正确的是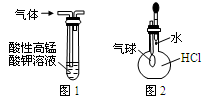
| A.用干燥pH试纸测定某新制氯水的pH |
| B.用图1装置除去乙烷中混有的乙烯 |
| C.用图2装置能验证HCl气体在水中的溶解性 |
| D.用25mL碱式滴定管量取20.00mL KMnO4溶液 |
下列叙述不正确的是
| A.根据某元素原子的质子数和中子数,可以确定该元素的相对原子质量 |
| B.CaCl2、MgCl2晶体都容易潮解,它们潮解的实质是晶体表面吸水形成溶液 |
| C.根据金属活动性顺序表,可以推断冶炼金属时可能的方法 |
| D.根据酸、碱、盐的溶解性表,可以判断某些溶液中的复分解反应能否进行 |
下列说法正确的是
| A.地沟油和矿物油都属于酯类物质 |
| B.在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 |
| C.为测定熔融氢氧化钠的导电性,将氢氧化钠固体放在石英坩埚中加热熔化 |
| D.蛋白质、棉花、淀粉、油脂都是由高分子组成的物质 |