偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (l)+2N2O4 (l)=2CO2 (g)+3N2(g)+4H2O(g) (I)
(1)反应(I)中氧化剂是_______。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g)  2NO2 (g) (Ⅱ) 一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________。
2NO2 (g) (Ⅱ) 一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________。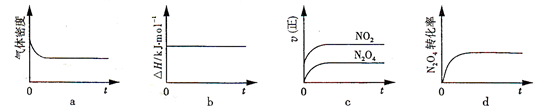
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=________mol·L-1·s-1。
(3)NO2可用氨水吸收生成NH4NO3。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是_____
_______________________________________________(用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5 mol·L-1,假设溶液的体积是bL)
某研究性学习小组欲由硫铁矿烧渣(主要成分为Fe、Fe2O3、SiO2、Al2O3)制备绿矾(FeSO4·7H2O)并测定烧渣中铁元素的含量,流程图如下:
(1)操作a的名称是。
(2)加入足量试剂X后,发生反应的离子方程式为、。
(3)向溶液2中滴加KSCN溶液,无明显现象。向固体中加入足量稀硫酸后,发生氧化还原反应的离子方程式是、。
(4)硫铁矿烧渣中铁元素的质量分数为。
A~G是中学化学常见物质,其中A为相同条件下密度最小的气体单质,E为红棕色气体。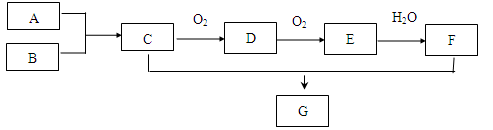
(1)G的化学式是。
(2)A和B反应生成C的化学方程式为。
(3)检验C可选用的试剂是(填字母)。
a.湿润的蓝色石蕊试纸 b.湿润的红色石蕊试纸 c.浓盐酸
(4)将盛满气体E的大试管倒扣在盛水的水槽中,发生反应的化学方程式为,现象为。
(5)汽车尾气中含有CO和物质D,一种治理方法是在汽车排气管上装一个催化转化装置,使CO和D反应,生成另外两种无毒气体。该反应的化学方程式是。
Na2CO3和NaHCO3是两种常见的钠盐。
(1)下列关于Na2CO3和NaHCO3性质的说法中,正确的是___________(填字母)。
a.常温下,Na2CO3在水中的溶解度比NaHCO3小
b.Na2CO3溶液和NaHCO3溶液均显碱性
c.可用Ca(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液
d.等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应,在相同条件下产生CO2的体积相同
(2)实验室利用下图所示装置进行Na2CO3和NaHCO3热稳定性对比实验。请回答:
物质A是(填化学式),写出其中一种物质受热分解的化学方程式。
(3)若要除去碳酸氢钠溶液中的碳酸钠,请用化学方程式表示除杂原理。
某同学用NaCl固体配制200 mL 1 mol/L的NaCl溶液,请回答下列问题。
(1)用托盘天平称取NaCl固体,其质量是______________ g。
(2)实验操作的正确顺序是(填序号)。
①继续加蒸馏水至液面距刻度线1~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切;;
②盖好容量瓶瓶塞,充分摇匀;
③把所得溶液冷却至室温后,小心转入容量瓶中;
④称量固体;
⑤用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶中
⑥ 把称量好的固体放入小烧杯中,加适量蒸馏水溶解。
(3)下列操作对溶液浓度有何影响(填“偏高”、“偏低”或“无影响”):
a.配制溶液时,容量瓶未干燥:
b.配制过程中,没有洗涤烧杯和玻璃棒:
c.定容时,俯视刻度线:
d.从配制好的溶液中取出10 mL :
工业上利用硅的氧化物制取硅单质,主要反应为:SiO2 + 2C  Si + 2CO↑。该反应中,还原剂是(填化学式),被还原的物质是(填化学式);若反应中消耗了2 mol C,则生成 _____mol Si,转移电子的物质的量为mol。
Si + 2CO↑。该反应中,还原剂是(填化学式),被还原的物质是(填化学式);若反应中消耗了2 mol C,则生成 _____mol Si,转移电子的物质的量为mol。