“天蓝蓝海蓝蓝,海边小城威海卫”。威海海水资源丰富,回答下列问题:
(1)海水中主要含有 等离子(写离子符号,至少答出4种)。
(2)海水脱硫是一种有效除去火力发电产生的SO2的方法。其工艺流程如下图所示:
天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是: ;氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是 。
(3)下图是海水综合利用的一个方面。
请回答下列问题:
I.①步主要反应的离子方程式: 。
溴及其化合物的用途有很多,写出其中的一种 。
II.第③步需要加入 ,其前面分离出氢氧化镁的操作称为 ,将镁条在二氧化碳中燃烧的产物为 。
III.粗盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤ 过滤 正确的操作顺序是
(6分)某同学在学习沉淀溶解平衡时发现以下表中信息:
| AgCl |
AgBr |
Ag2CrO4 |
|
| 颜色 |
白色 |
浅黄色 |
砖红色 |
| 溶解度(mol·L-1) |
1.3×10-4 |
1.7×10-7 |
6.5×10-5 |
| 溶度积常数(KSP) |
1.7×10-12mol2·L-2 |
5.0×10-13mol2·L-2 |
? |
(1)请利用表中信息计算Ag2CrO4的溶度积常数KSP = ;
(2)沉淀滴定所用的指示剂本身就是一种沉淀剂,用AgNO3滴定KCl溶液中Cl-的含量时甲同学想用K2CrO4作指示剂;
①现有浓度均为0.001mol·L-1的KCl和K2CrO4的混合液,该同学取混合液20mL,用已知浓度的AgNO3溶液滴定,试计算当Cl-沉淀完全时,CrO42-是否开始沉淀(当溶液中某离子浓度小于1×10-5mol·L-1时认为沉淀完全)。
②根据表中信息和上述计算,请判断K2CrO4能否用作AgNO3滴定KCl实验的指示剂(填“能”或“不能”);若能则滴定终点的颜色变化是(若不能该空不填)。
如下图,甲、乙、丙分别表示在不同条件下可逆反应:
A(g)+B(g) xC(g)的生成物C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
xC(g)的生成物C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
请根据图象回答下列问题:
(1)若甲图中两条曲线分别表示有催化剂和无催化剂的情况,则曲线表示无催化剂时的情况(填字母,下同);
(2)若乙图表示反应达到平衡后分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入惰性气体后的情况,则曲线表示恒温恒容的情况;
(3)根据丙图可以判断该可逆反应的正反应是热反应(填“吸”或“放”),计量数x的值(填取值范围);判断的依据分别是 。
如图所示装置,X、Y为电源的两极,a、b均为石墨电极,c为铜电极,d为铁电极,A槽中盛装饱和食盐水,B槽中盛装CuCl2溶液。通电一段时间后,发现d电极上覆盖一层红色物质。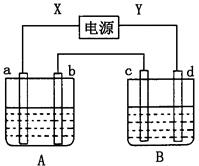
根据以上实验事实,回答下列问题:
(1)c极的电极反应式为 ;
(2)A槽中发生反应的离子方程式为;
(3)A槽中溶液的pH(填“变大”、“变小”或“不变”)。
氢能是高效、清洁能源,制氢技术的研究开发是氢能利用的必由之路。燃料水蒸气重整法是一种有效、经济、广泛采用的制氢方法,它是通过水蒸气与燃料间的反应来制取氢气的。
(1)在催化剂作用下,天然气和水蒸气反应可制得一氧化碳和氢气,已知该反应每制得1kg氢气需要吸收3.44×104 kJ热量。写出该反应的热化学方程式 ;
(2)CO可继续与水蒸气反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.0kJ·mol-1。若将1mol甲烷与足量水蒸气充分反应得到1molCO2,该反应的焓变ΔH=;
(3)欲制得较纯净的氢气,可将(2)中充分反应后的气体通过足量的烧碱溶液,写出该反应的离子方程式 ;
有机物A由碳、氢、氧三种元素组成。现取3g A与4.48L(标准状况)氧气在密闭容器中充分燃烧,生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰充分吸收,浓硫酸增重3.6g,碱石灰增重4.4g,剩余气体体积为1.12L(标准状况)。回答下列问题:
(1)3g A燃烧后生成物的物质的量分别为:
n(H2O)= ______,n(CO2)= ______,n(CO)= ______。
(2)通过计算确定A的分子式__________。
(3)写出A的一种可能的结构简式_______________________。