把2.0 mol CuSO4和1.0 mol
CuSO4和1.0 mol H2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前两种溶液的体积之和)计算:
H2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前两种溶液的体积之和)计算:
(1)混合溶液中CuSO4和H2SO4的物质的量浓度
(2)混合液中和的物质的量浓度
(3)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余。此时溶液中的物质的量浓度。c(Fe2+)=_______________________。
有机物A(C6H8O4)为食品包装纸的常用防腐剂。A可以使溴水褪色。A难溶于水,但在酸性条件下可发生水解反应,得到B(C4H4O4)和甲醇。通常状况下B为
无色晶体,能与氢氧化钠溶液发生反应。
(1)A可以发生的反应有(选填序号)。
① 加成反应 ② 酯化反应 ③ 加聚反应 ④ 氧化反应
(2)B分子中没有支链,其结构简式是
(3)由B制取A的化学方程式是。
如图所示,利用海洋可提取很多重要的化工原料。
A、B、C、D、E、F、G都是短周期元素,原子序数依次增大,B、C、D同周期,A、E同主族,D、G同主族。A、C能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。B元素原子有两个未成对电子,D是周期表中电负性最大的元素,F是地壳中含量最多的金属元素。根据以上信息回答下列问题:
(1)写出A、C、E三种元素的符号:
A, C, E。
(2)甲、乙两分子中含有非极性共价键的是(填分子式)。
(3)C、D、F的离子中,半径最小的是(填离子符号)。.
(4)在气态单分子化合物FG3中元素F的杂化方式为:杂化,FG3的空间构型为。
空气质量高低直接影响着人类的生产和生活,它越来越受到人们的关注。被污染的空气中杂质的成分有多种,其中计入《空气质量日报》空气污染指数的项目有SO2、CO、NO2、O3和可吸入颗粒物等。
请回答下列问题:
(1)S、N、O的第一电离能由大到小的顺序为。
(2)血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒。
①写出亚铁离子的基态电子排布式。
② CO有多种等电子体,其中常见的两种为。CO结构中σ键和П键数目之比为。
③Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 ___________(填晶体类型),Fe元素的化合价。
(3)SO2是一种大气污染物,为减轻SO2污染,火力发电厂生产中常在燃煤中加入CaO以“固硫”。 CaO晶胞如右图所示,其中Ca2+周围的阴离子配位数为,CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO:3401kJ/mol、NaCl:786kJ/mol。CaO晶体的熔点NaCl晶体的熔点(填“高于”、“等于”或“低于”),导致两者晶格能差异的主要原因是。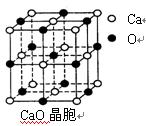
(4)随着人们生活质量的提高,不仅室外的环境安全为人们所重视,室内的环境安全和食品安全也越来越为人们所关注。甲醛是室内主要空气污染物之一(其沸点是-19.5 ℃),甲醇是“假酒”中的主要有害物质(其沸点是64.65 ℃),甲醇的沸点明显高于甲醛的主要原因是:。
氮是地球上极为丰富的元素。2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮,晶体片段结构如右图所示。每个氮原子都通过3个单键与其它氮原子结合并向空间发展构成立体网状结构。这种高聚氮的N-N键的键能为160kJ/mol,而N2的键能为942kJ/mol。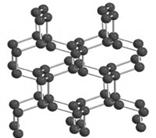
(1)请根据以上信息写出固态高聚氮爆炸成氮气的热化学方程式:。
(2)N≡N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-3,计算说明N2中的键比键稳定(填“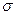 ”“
”“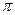 ”)。
”)。
(3)Li3N晶体中氮以N3-存在,基态N3-的电子排布式为。
(4)2008的秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺
(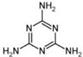 )。
)。
下列关于三聚氰胺分子的说法中正确的是。
A.所有碳原子采用sp2杂化,所有氮原子采用sp3杂化
B.一个分子中共含有15个σ键
C.属于极性分子,故极易溶于水
D.形成的晶体熔点较高
(5)继C60后,科学家又合成了N60、Si60、KnC60等,C、Si、N、K原子电负性由大到小的顺序是 > > >。
图表法、图象法是常用的科学研究方法。
I.短周期某主族元素M的电离能情况如图(A)所示。则M元素位于周期表的第族。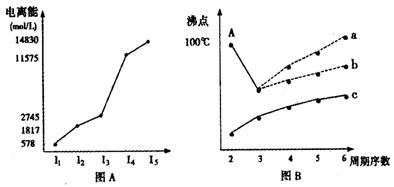
II.图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b,你认为正确的是:,理由是:
。
CH4、NH3、H2O、HF四种氢化物的沸点从高到低的顺序: > > >。
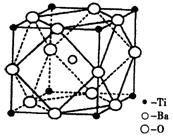
III.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛被誉为“未来世纪的金属”。试回答下列问题:
(1)22Ti元素基态原子的外围电子排布式为。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,是很好的压电材料。偏钛酸钡晶体中晶胞的结构示意图如右图,则它的化学式是;每个氧离子周围的钛离子的配位数为,每个钡离子周围的氧离子配位数位为。