下列实验误差分析错误的是
| A.用润湿的pH试纸测稀碱溶液的pH,测定值偏小 |
| B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 |
| C.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 |
| D.测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度差值偏小 |
如图各装置不能达到实验目的的是()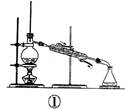
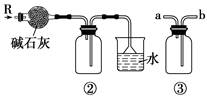
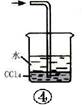
| A.装置①可用于由工业酒精制取无水酒精 | B.装置②可用于干燥、收集氨气,并吸收多余的氨气 |
| C.装置③可用于排空气法收集NO气体 | D.装置④中下层物质若为四氯化碳,则可用于吸收氯化氢 |
设NA代表阿伏加德罗常数的数值,下列说法中不正确的是()
| A.常温常压下,20 g重甲基(-14CD3)所含的中子数为11NA; |
| B.常温常压下,22.4 L NO气体的分子数小于NA; |
| C.64 g铜发生氧化还原反应,一定失去2NA个电子; |
| D.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA; |
下列各组离子,在pH=0的溶液中可以大量共存的是()
| A.Al3+、Fe3+、Br—、SO42— |
| B.K+、Ca2+、SO42—、Cl— |
| C.Na+、Cu2+、I—、NO3— |
| D.NH4+、K+、HPO42—、Cl— |
下列叙述正确的是()
| A.汽油、柴油和植物油都是碳氢化合物 |
| B.浓H2SO4具有吸水性,可用来干燥氨气 |
| C.金属铝的生产是以Al2O3为原料,在熔融状态下进行电解 |
| D.糖类、蛋白质、油脂属于天然高分子化合物 |
据下表信息,判断以下叙述正确的是( )部分短周期元素的原子半径及主要化合价
| 元素代号 |
G |
L |
M |
Q |
R |
T |
| 原子半径/nm |
0.186 |
0.160 |
0.143 |
0.104 |
0.075 |
0.066 |
| 主要化合价 |
+1 |
+2 |
+3 |
+6、-2 |
+5、-3 |
-2 |
A.GOH溶液和M(OH)3可以相互反应
B.非金属性:T<Q
C.气态氢化物的稳定性:R>T
D.L2+与T2-核外电子数相等