短周期元素X、Y、Z、W 的原子序数依次增大,X原子的最外层电子数是内层电子数的2倍,X与Z同主族,Y和氢元素同主族,W原子的最外层电子数比次外层电子数少1。下列说法正确的是
| A.元素X形成的单质一定是原子晶体 |
| B.原子半径的大小顺序:r(W)>r(Z)>r(Y) >r (X) |
| C.Y与氧元素形成的化合物Y2O2中阴、阳离子的个数比为1:2 |
| D.W分别与Y、Z形成的化合物中含有的化学键类型相同 |
在某溶液中酚酞呈粉红色,下列离子在该溶液中不能大量存在的是
| A.K+ | B.Na+ | C.Al3+ | D.Ba2+ |
配制250 mL 0.10 mol·L―1的NaOH溶液时,下列实验操作会使配得的溶液浓度偏大的是()
| A.转移溶液后未洗涤烧杯和玻璃棒就直接定容 |
| B.NaOH固体溶解后立即转入容量瓶 |
| C.在容量瓶中进行定容时仰视刻度线 |
| D.定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度线 |
下列说法中,正确的是
| A.为加快过滤速度,可用玻璃棒在过滤器中搅拌 |
| B.胶体、溶液、浊液分属不同类别的本质是其透过滤纸的性质不同 |
| C.分液漏斗和容量瓶使用前都需要检查是否漏液 |
| D.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
下列说法正确的是(NA表示阿伏加德罗常数的值)
| A.28g氮气所含有的原子数目为NA |
| B.在常温常压下,11.2L N2含有的分子数为0.5NA |
| C.0.5mol 单质铝与足量盐酸反应转移电子数为1.5NA |
D.标准状况下,1L水所含分子数为 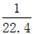 NA NA |
下列反应中,不属于四种基本反应类型,但属于氧化还原反应的是
| A.2Na + 2H2O =" 2NaOH" + H2↑ |
| B.CH4 + 2O2 =CO2 +2H2O |
| C.2KClO3 =" 2KCl" + 3O2↑ |
| D.CaCO3+2HCl = CaCl2+H2O+CO2↑ |