N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)  4NO2 (g)+ O2(g) ΔH > 0 T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2 (g)+ O2(g) ΔH > 0 T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
| 时间/s |
0 |
500 |
100 0 |
150 0 |
| c(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.50 |
2.50 |
下列说法中不正确的是 ( )
A.500 s内N2O5分解速率为2.96×10-3mol·L-1·s-1
B.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D.达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)> 5.00 mol·L-1
下列物质属于纯净物的是()
| A.酚醛树脂 | B.福尔马林 | C.葡萄糖 | D.纤维素 |
下列说法不正确的是()
| A.1828年贝采里乌斯的学生维勒首次在实验室里合成了尿素,取得令科学界震惊的成果 |
| B.1965年,我国科学家首次由氨基酸合成了结晶牛胰岛素,这是第一个由全人工合成的、与天然产物性质完全相同的、具有生物活性的蛋白质 |
| C.饱和一元醇的沸点比与其相对分子质量接近的烷烃或烯烃的沸点要高,这主要是因为氢键的存在增强了醇分子间的相互作用 |
| D.皂化反应是指油脂在酸性条件下的水解反应 |

 已知断开1 mol H2中的化学键需要吸收436KJ的能量,断开1 mol Cl2中的化学键需要吸收243KJ的能量,而形成1mol HCl分子中的化学键要释放431KJ的能量,则1mol氢气与1mol氯气反应时能量变化为:
已知断开1 mol H2中的化学键需要吸收436KJ的能量,断开1 mol Cl2中的化学键需要吸收243KJ的能量,而形成1mol HCl分子中的化学键要释放431KJ的能量,则1mol氢气与1mol氯气反应时能量变化为:
| A.吸收183KJ | B.吸收366KJ | C.放出183KJ | D.放出366KJ |
下列关于元素周期表的叙述,正确的是:
| A.ⅡA族中无非金属元素 | B.Ⅷ族中所含元素种类最多 |
| C.元素周期表中18个纵行对应18个族 | |
| D.零族的所有元素均满足最外层电子数为8 |
下列电子式书写正确的是:
A.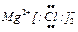 |
B.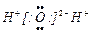 |
C.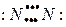 |
D.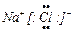 |