氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下: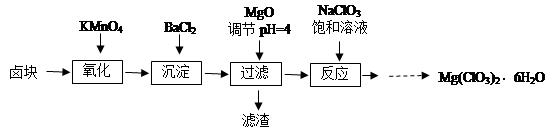
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S )随温度(T )变化曲线如图所示。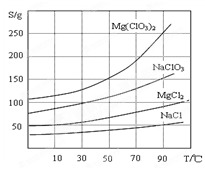
(1)过滤所需要的主要玻璃仪器有 。
(2)加入BaCl2的目的是 ,加MgO后过滤所得滤渣的主要成分为 。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7 溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7 溶液15.00 mL。
①写出步骤2中发生反应的离子方程式: ;
②产品中Mg(ClO3)2·6H2O的质量分数为 。
氯气和氯乙烯都是重要的化工产品,年产量均在107t左右。氯气的实验室制备和氯乙烯的工业生产都有多种不同方法。
完成下列填空:
(1)实验室制取纯净的氯气,除了二氧化锰、浓盐酸和浓硫酸,还需要_________、________(填写试剂或溶液名称)
(2)实验室用2.00mol/L的盐酸和漂粉精[成分为Ca(ClO)2、CaCl2]反应生成氯气、氯化钙和水,若产生2.24L(标准状况)氯气,发生反应的盐酸为_________m,l。
(3)实验室通常用向上排空气法收集氯气。设计一个简单实验,验证所收集的氯气中是否含有空气。
_________________
(4)工业上用电石-乙炔法生产乙烯的反应如下:
CaO+3C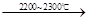 CaC2+CO
CaC2+CO
CaC2+2H2O→HC≡CH↑+Ca(OH)2
HC≡CH↑+HCl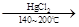 CH2=CHCl
CH2=CHCl
电石-乙炔法的优点是流程简单,产品纯度高,而且不依赖于石油资源。
电石-乙炔法的缺点是___________________、_____________________。
(5)乙烷和氯气反应可制得ClCH2CH2Cl,ClCH2CH2Cl加热分解得到氯乙烯和氯化氢。设计一种以乙烯和氯气为原料制取氯乙烯的方案(其他原料自选),用化学方程式表示(不必注明反应条件)。
要求:①反应产生的氯化氢必须用于氯乙烯的制备;②不再产生其他废液。
___________________________________
Ⅰ.现有含CaO杂质的CaC2试样。设计以下实验,测定CaC2试样的纯度。
(反应方程式为:CaC2 + 2H2O→Ca(OH)2 + C2H2↑),请从下图中选用适当的装置,完成该实验。
(1)制取C2H2最好选④中的 ,所选用装置的连接顺序是(填各接口A~E的顺序): 。
(2)若实验时称取的试样为1.4g,产生的乙炔在标准状况下的体积为448mL,此试样中CaC2的质量分数为______________。(保留3位有效数字)
Ⅱ.某同学在实验室从如下图标签的试剂瓶中取少许钠进行燃烧实验,实验后发现还有少许黑色固体生成。从反应物及实验操作猜测:该黑色物质可能为炭与另一种氧化物组成的混合物。
根据题意和图示回答下面问题:
(1)装置图Ⅱ中A的名称_________。
(2)此氧化物可能是_____或_____(写化学式)
(3)对黑色固体物质的组成作如图所示探究
①实验I加入盐酸溶液的目的是_______;
②仅通过实验Ⅱ,用最简步骤能快速确定黑色氧化物的组成,请完善该设计。(限选试剂:稀盐酸、KSCN溶液、10%H2O2溶液)
| 实验操作 |
预期现象与结论 |
相关离子方程式 |
| 取少量实验Ⅰ中的澄清溶液,加入试剂 。 |
。 |
。 |
化学兴趣小组用下图所示装置进行探究实验。以验证产物中有乙烯生成且乙烯具有不饱和性。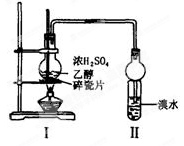
当温度迅速上后,可观察到试管中的溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色。(已知:二溴乙烷密度2.18 g·cm-3,不易溶于水,易溶于醇、醚、丙酮等有机溶剂)。
请回答下列问题:
(1)该实验中生成乙烯的化学方程式:_______________________________________。
(2)甲同学认为:该混合液体反应复杂,溴水褪色的现象不能证明反应中有乙烯生成及乙烯具有不饱和性。下列理由中正确的是 __________(填选项)。
A.乙烯与溴水易发生取代反应
B.使溴水褪色的反应,未必是加成反应
C.使溴水褪色的物质,未必是乙烯
D.浓硫酸氧化乙醇生成乙酸,也会使溴水褪色
(3)乙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加了如下图所示装置。
则A中的试剂应为 ___________,B中的试剂为____________。
(4)丙同学经过观察后认为:试管中另一现象可证明反应中有乙烯生成,这个现象是:___________;为验证这一反应是加成反应而不是取代反应,可用pH试纸来测试反应前后溶液的酸性变化,原理是:_____________________。
(5)处理上述实验后烧瓶中废液,最合理的方法是______________(填选项)。
A.废液经冷却后倒入下水道中
B.废液倒入空废液缸中
C.将水加入烧瓶中稀释后倒入废液缸
D.废液倒入盛有水的塑料桶中,经处理后再倒入下水道
已知用P2O5作催化剂,加热乙醇可制备乙烯,反应温度为80℃~210℃。某研究性小组设计了如下的装置制备并检验产生的乙烯气体(夹持和加热仪器略去)。
(1)仪器a的名称为 。
(2)用化学反应方程式表示上述制备乙烯的原理 。
(3)已知P2O5是一种酸性干燥剂,吸水放出大量热,在实验过程中P2O5与乙醇能发生作用,因反应用量的不同,会生成不同的磷酸酯,它们均为易溶于水的物质,沸点较低。写出乙醇和磷酸反应生成磷酸二乙酯的化学方程式(磷酸用结构式表示为 ) 。
) 。
(4)该装置中还缺一种必备仪器,该仪器为 。某同学认为即使添加了该仪器上述装置验证产生了乙烯不够严密,仍须在酸性高锰酸钾溶液之前添加洗气装置,其理由为 。
下图是实验室用来验证乙烯与氢气反应产物的装置,请回答下列问题:
(1)此装置用来制取乙烯,其中包括的仪器是:
①碎瓷片②石棉网和铁架台③圆底烧瓶④温度计(量程 100℃)⑤温度计(量程200℃)⑥酒精灯⑦单孔塞⑧双孔塞⑨导管。不选用的仪器有___________(填其序号)
(2)写出实验室制取乙烯的化学方程式 。
(3)此处碱石灰的作用是 。
(4)实验过程中,发现溴水会褪色,可能的原因是 。
(5)装置中点燃的气体刚开始为,出现什么现象可说明生成了乙烷?