短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是
| A.元素W的氢化物的稳定性比X的氢化物稳定性强 |
| B.元素Y的最高价氧化物对应水化物为强碱 |
| C.化合物YX、ZX2、WX2中化学键类型相同 |
| D.原子半径的大小顺序:rY>rZ>rW>rX |
食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)、聚偏二氯乙烯(PVDC)等种类。PVC被广泛用于食品、蔬菜的外包装,但它对人体有潜在危害。下列有关叙述中不正确的是( )
A.PVC保鲜膜属于链状聚合物,在高温时易熔化,能溶于酒精
B.PVC的单体不能由PE的单体与氯化氢加成制得
C.鉴别PE和PVC,可将其放入试管中加热,在试管口放置一湿润的蓝色石蕊试纸,如果试纸变红,则为PVC;不变红,则为PE
D.等质量的聚乙烯和乙烯分别完全燃烧,聚乙烯消耗的氧气多
下列对于废弃塑料制品的处理方法中最有前景的是( )
| A.积极寻找纸等纤维类制品替代塑料 |
| B.将废弃物焚烧 |
| C.将废弃物填埋或倾倒于海洋中 |
| D.将废弃物用化学方法加工成防水涂料与汽油 |
橡胶是一种重要的战略物质,一般分为天然橡胶和合成橡胶两类。丁苯橡胶是合成橡胶的一种,其结构简式为: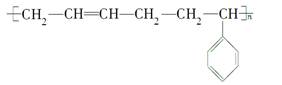
下列说法正确的是( )
A.它的单体是 |
B.丁苯橡胶是 和 和 通过缩聚反应制得的 通过缩聚反应制得的 |
| C.装液溴或溴水的试剂瓶可用丁苯橡胶作瓶塞 |
| D.丁苯橡胶会老化 |
一种有机玻璃的结构如图所示。关于它的叙述不正确的是( )
| A.该有机玻璃是一种线型结构的高分子材料 |
| B.该有机玻璃的化学名称为聚甲基丙烯酸甲酯 |
| C.可用过滤方法除去CCl4中的少量该有机玻璃 |
| D.它在一定条件下发生水解反应时,C—O键发生断裂 |
温室效应引起国际的关注,我国也积极应对,采取措施。中科院首创用CO2合成可降解塑料聚二氧化碳。下列相关说法合理的是( )
| A.聚二氧化碳塑料是通过加聚反应制得的 |
| B.聚二氧化碳塑料与干冰互为同素异形体 |
| C.聚二氧化碳塑料的使用也会产生白色污染 |
| D.聚二氧化碳塑料与干冰都属于纯净物 |