分I:化学是一门以实验为主的科学,化学实验是学习探究物质性质的基本方法之一。(1)化学实验中,常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是
| A.定性检验SO32-,可用HNO3酸化的BaCl2溶液 |
| B.配制FeCl2溶液时通常加少量HNO3酸化,减小其水解程度 |
| C.检验某溶液中是否含Cl-,用HNO3酸化的AgNO3溶液 |
| D.酸性高锰酸钾溶液经常用盐酸酸化 |
(2)下列有关说法中正确的有
①用pH试纸测得氯水的pH为3.5
②用瓷坩埚高温熔融NaOH固体
③加入浓NaOH溶液,加热产生使湿润的红色石蕊试纸变蓝的气体,则原溶液中一定含有NH4+
④向溶液中加入少量双氧水,再加几滴KSCN溶液后溶液变红,则原溶液中一定含有Fe2+
⑤实验时不慎被玻璃划破手指,引起轻微流血时,可用三氯化铁溶液涂抹止血
II:(1)某温度下,纯水中c(H+)=2.0×10-7mol·L-1.该温度下,0.9mol·L-1NaOH溶液与0.1mol·L-1 HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH= 。
(2)向含有0.020 molCH3COOH的溶液中加入0.020mol CH3COONa固体,溶液pH增大,主要原因是 ;已知该混合溶液中c(Na+)<c(CH3COO-),则c(CH3COOH) c(CH3COO-)(用“>”、“<”、“=”符号填空)。
(3)常温下,向100 mL 0.01mol·L-1HA溶液逐滴加入0.02mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。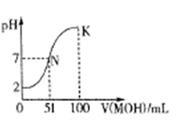
回答下列问题:
①由图中信息可知HA为 酸(填“强”或“弱”)。
②K点对应的溶液中,c(M+)+c(MOH)= mol·L-1。
右图是硫酸试剂瓶标签上的内容:
(1)该硫酸的物质的量浓度是mol/L。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要240 mL 4.6 mol/L的稀H2SO4,则需要取mL的该硫酸,将上述硫酸进行稀释的实验操作为。
(3)在配制4.6 mol/L稀H2SO4的过程中,下列情况对硫酸溶液物质的量浓度有何影响(填“偏高”、“偏低”或“无影响”)。①未经冷却趁热溶液注入容量瓶中:。
②容量瓶用1mol/L稀H2SO4润洗:。③定容时仰视观察液面。
(4)常温下,某学生取出少量试剂瓶中的硫酸于一洁净试管中,加入几片铝,结果铝片表面没有气泡产生,也未发现铝片溶解,试帮助该同学分析其原因。
有下列词语:①渗析②盐析③聚沉④溶胶⑤凝胶⑥布朗运动⑦电泳
⑧丁达尔效应⑨中和⑩水解,选出适当的词语将其序号填入下列空格中。
(1)往浓肥皂中加入饱和食盐水(或固体食盐),肥皂凝聚,这种现象称为 。
。
(2)在肥皂水中透过强光,可看到光带,这种现象称为。
(3)使热的浓肥皂水冷却并完全固化后的物质叫。
(4)在肥皂水中加入酚酞变红色,说明高级脂肪酸根离子发生了。
(5)在Fe(OH)3胶体中加入(NH4)2SO4产生红褐色沉淀,这种现象叫做。
(6)用半透膜把制取Fe(OH)3胶体中生成的氯化钠分离出的方法叫做。
(7)在水泥和冶金工厂常用高压电对气溶胶作用,除去大量烟尘,以减少对空气的污染。这种做法应用的主要原理是。
储氢纳米碳管研究成功体现了科技的进步。但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应,式为:
C + K2Cr2O7 + H2SO4→ CO2 + Cr2(SO4)3+ K2SO4 + H2O
(1)完成并配平上述反应的化学方程式并标出电子转移方向与数目;
(2)此反应的氧化剂是,氧化产物是;
(3)H2SO4在上述反应中表现出来的性质是(填选项编号)
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
(4)上述反应中若产生0.1mol CO2气体,则转移电子的 物质的量是mol。
物质的量是mol。
某反应中反应物与生成物有:AsH3、H2S04、KBr03、K2SO4、H3AsO4、H20和一种
未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是
(2)已知O.2molKBrO3在反应中得到1 mol电子生成X.则X的化学式为。
(3)根据上述反应可推知。
a.氧化性:KBrO 3> H3AsO4
3> H3AsO4
b.氧化性:H3AsO4>KBr03
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)组合并配平有上述物质参加和生成的反应化学方程式:

2008年11月1 日上午lO时许,在镇江支路12号青岛亨通达实业有限公司热电厂院内,8 231.25公斤含有三聚氰胺(结构简式为: )的乳制品在工商、质监等部门的监管下,和煤炭掺搅在一起填炉焚烧销毁.
)的乳制品在工商、质监等部门的监管下,和煤炭掺搅在一起填炉焚烧销毁.
根据上述信息,回答下列问题:
(1)三聚氰胺属于.
A.铵盐 B.高分子化合物 C.有机物 D.蛋白质
(2)下列属于纯净物的是.
A.煤炭 B.三聚氰胺 C.不含三聚氰胺的奶粉 D.聚乙烯
(3)奶粉中含有蛋白质,溶于水后形成的分散系称为,若用一束光照射该分散系,会发现.
(4)三聚氰胺的化学式是,其中氮元素的质量分数为,不法商人及企业在奶粉及牛奶中掺入三聚氰胺的目的是