(12分) 硫酸锌被广泛应用于工农业生产和医药领域.工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO4·7H2O的一种流程如下: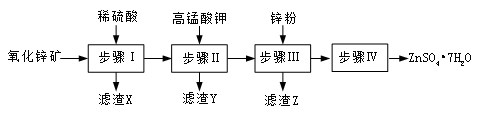
(1)步骤Ⅰ包括酸浸和过滤两个操作。
①酸浸时,需不断通入高温水蒸气的目的是 。
②过滤时为防堵塞,过滤装置需常用NaOH溶液清洗,其清洗原理是 (用化学方程式表示)。
(2)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为 。
(3)步骤Ⅲ所得滤渣Z的主要成分是 。
(4)取28.70 g ZnSO4·7H2O加热至不同温度,剩余固体的质量变化如下图所示。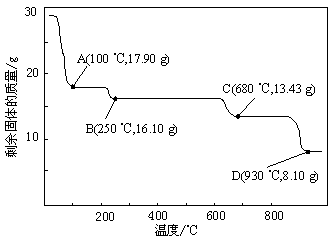
①步骤Ⅳ中的烘干操作需在减压条件下进行,其原因是 。
②在图中C点,680 ℃时所得固体的化学式为 (填字母序号)。
a.ZnO b.ZnSO4 c.ZnSO4·H2O d.Zn3O(SO4)2
d.Zn3O(SO4)2
)氮元素的化合价较多,负价态氮与正价态氮之间发生氧化还原反应时会有氮气产生。下面是甲、乙两位学生提出的两种制备少量氮气的实验方案(箭头表示气体的流向)。
甲:空气→碱石灰→红磷(点燃)→水→铜粉(灼热)→集气瓶
乙:NH4NO2(加热)→浓硫酸→镁粉(灼热)→集气瓶(提示:NH4NO2 N2↑+2H2O)
N2↑+2H2O)
回答下列问题:
(1)甲、乙两位学生的实验方案是否能制氮气?
甲 、乙 (填“能”或“不能”)。
(2)具体说明不能制取氮气的原因并纠正(若两种方案都能制氮气,此小题不用回答) 。
(3)甲方案中碱石灰和乙方案中浓硫酸可否交换位置?说明理由:
。
今年我国多个城市遭雾霾天气,这表明污染严重,空气质量下降。因此研究NO2、SO2、CO等大气污染气体的处理具有重要现实意义。
(1)NO2可用水吸收,相应的化学反应方程式为 。
(2)利用反应6NO2+8NH3 7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是 L。
7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是 L。
(3)硝酸工业尾气中含NO和NO2气体,常用NaOH溶液来吸收,反应方程式为NO+NO2+2NaOH====2NaNO2+H2O,该反应中氧化剂和还原剂的物质的量之比是 。
(4)SO2是形成酸雨的主要物质,可以用氨水吸收消除污染,写出过量氨水与SO2反应的离子方程式 。
含硫化合物的种类很多,现有H2SO4、H2SO3、SO2、Na2SO3、BaSO4、CuSO4、Na2SO4这7种常见的含硫化合物。回答下列问题:
(1)H2SO3转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式,并标明电子转移方向和数目
。
(2)Ba2+有剧毒。某市曾发生一起“毒烧饼”事件,起因是烧饼摊主在制作烧饼的过程中误将碳酸钡当作干粉使用,导致多人食用烧饼后中毒。试写出碳酸钡与胃酸(以盐酸表示)反应的离子方程式
。
患者被送往医院后,医生往往让其服用
(填题干所列7种物质中的1种)来解毒。
(3)常温下,将铁棒置于浓硫酸中,无明显现象,有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面
,
则发生了钝化;若铁棒表面 ,则未发生反应。
为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分: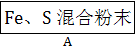
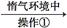
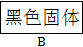
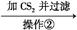
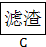

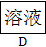
请回答下列问题:
(1)混合粉末A中硫粉过量的原因是
。
(2)反应在“惰气环境”中进行的原因是
。
(3)操作①用烧热的玻璃棒点触混合粉末,反应即可持续进行,说明
。
(4)操作②的作用是
。
(5)操作③稀硫酸煮沸的目的是
。
(6)为了证明产物中铁元素的价态,对D溶液的实验操作最好是
。
有A、B两种常温下有刺激性气味的气体,将黄绿色气体A通入品红溶液中,品红溶液变为无色;将气体B通入品红溶液中,品红溶液也变为无色;将气体A和气体B按1∶1的体积比混合充分,通入品红溶液中,品红溶液不褪色,通入紫色石蕊试液中,溶液只变红不褪色。试回答下列问题:
(1)写出A、B的化学式: 、 。
(2)写出A和NaOH溶液反应的化学方程式:
。
(3)写出B与NaOH溶液反应的离子方程式:
。
(4)写出A与B按1∶1的体积比混合通入水中充分反应的化学方程式:
。
(5)加热通入A后变为无色的品红溶液,现象是
;
加热通入B后变为无色的品红溶液,现象是
。