氨是最重要的化工产品之一。
(1)合成氨用的氢气可以甲烷为原料制得。有关化学反应的能量变化如下图所示。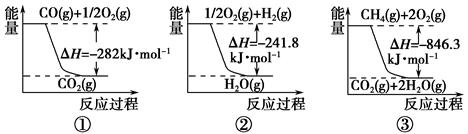
反应①②③为________反应(填“吸热”或“放热”)。
CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为___________。
(2)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。
①某温度下,向容积为10 L的密闭容器中通入2 mol NH3和1 mol CO2,反应达到平衡时CO2的转化率为50%。该反应的化学平衡常数表达式为K=______。该温度下平衡常数K的计算结果为_____。
②为进一步提高CO2的平衡转化率,下列措施中能达到目的的是________。
| A.提高NH3的浓度 | B.增大压强 |
| C.及时转移生成的尿素 | D.使用更高效的催化剂 |
右表是元素周期表的一部分。(共7分)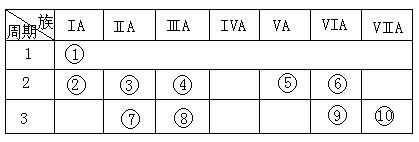
(1)表中元素⑩的氢化物的化学式为,此氢化物的还原性比元素⑨的氢化物的还原性(填强或弱)
(2)某元素原子的核外p电子数比s电子数少1,则该元素的元素符号是,其单质的电子式为。
(3)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式
又如表中与元素⑦的性质相似的不同族元素是(填元素符号)
一种离子晶体的晶胞如右图。其中阳离子A以 表示,阴离子B以
表示,阴离子B以 表示。
表示。
(1)每个晶胞种含A离子的数目为________,含B离子数目为________。
(2)若A的核外电子排布与Ar相同,B的电子排布与Ne相同,则该离子化合物的化学式是___________________;
(3)阳离子的配位数为_________,阴离子的配位数为________。
(4)已知A的离子半径为0.99×10-10m,则该晶胞的体积是_______________m3。
(每空2分,共12分)
(每空1分,共12分)
H2O 分子构型,中心原子采取杂化,属于分子(填极性或非极性)
SO3 分子构型,中心原子采取杂化,属于分子(填极性或非极性)
HCN分子构型,中心原子采取杂化,属于分子(填极性或非极性)
CH4 构型,中心原子采取杂化,属于分子(填极性或非极性)
铜是第四周期重要的过渡元素之一,其单质及化合物具有广泛用途。
请回答下列有关问题:
⑴铜原子的基态电子排布式是 ▲。比较第一电离能Cu ▲Zn(填 “>”、“=”、“<”),说明理由 ▲。
⑵氮和铜形成某种化合物的晶胞结构如图所示,则其化学式为 ▲。(每个球均表示1个原子)
⑶铜可以形成多种多样的配合物。
① NH3可以和很多过渡金属形成配合物。NH3分子中心原子的杂化类型为 ▲ 杂化,与NH3互为等电子体的粒子有 ▲。(只写其中一种)
②向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。试用离子方程式表示其原因 ▲ 、 ▲ 。
⑷在绿色植物标本的制作过程中,将植物材料洗净后浸入5%的硫酸铜溶液中,叶绿素(如图1)中心离子Mg2+被置换成Cu2+(如图2),叶片则永保绿色,请在图2中用箭头表示出配位键。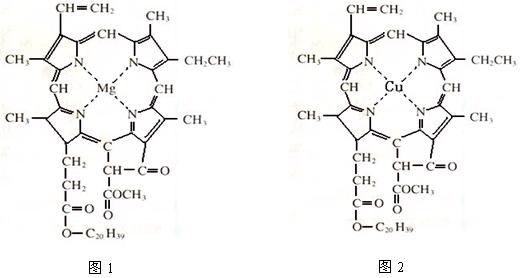
在含有弱电解质的溶液中,往往有多个化学平衡共存。
⑴现将0.04mol·L-1的HA溶液与0.02mol·L-1的NaOH溶液等体积混合。如HA是HCN,溶液中c(Na+)>c(CN-),则该混合溶液c(H+) ▲c(OH-)(请填“>”“<”或“=”),c(HCN)+c(CN-)= ▲mol·L-1。如HA是CH3COOH,该混合溶液呈酸性,c(CH3COOH) ▲c(CH3COO-)(请填“>”、“<”或“=”)。
⑵常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示。回答下列问题:
①在同一溶液中,H2CO3、HCO3-、 CO32- ▲(填:“能”或“不能”)大量共存。
②当pH=7时,溶液中各种离子其物质的量浓度之间的等量关系是: ▲ 。
⑶已知在25℃时,CO32-水解反应的平衡常数即水解常数
Kh==2×10-4,当溶c(HCO3-)︰c(CO32-)=20︰1时,溶液的pH=_▲_。