已知元素A、B、C、D、E、F均属前四周期且原子序数依次增大,A的p能级电子数是s能级的一半,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F的内部各能层均排满,且最外层电子数为1。
请回答下列问题:
(1)C原子基态时电子排布式为 。
(2)B、C两种元素第一电离能为: > (用元素符号表示)。试解释其因: 。
(3)任写一种与AB_离子互为等电子体的离子 。
(4)B与C形成的四原子阴离子的立体构型为 ,其中B原子的杂化类型是 。
(5)F(OH)2难溶于水,易溶于氨水,写出其溶于氨水的离子方程式 。
(6)D和E形成的化合物的晶胞结构如图,其化学式为 ,∠EDE= ;E的配位数是 ;已知晶体的密度为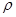 g·cm-3,阿伏加德罗常数为NA,则晶胞边长a= cm.(用
g·cm-3,阿伏加德罗常数为NA,则晶胞边长a= cm.(用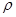 、NA的计算式表示)
、NA的计算式表示)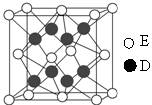
在恒温、恒容的密闭容器中发生反应:N2O4(g)====2NO2(g)。
(1)20 s内N2O4的浓度由0.1 mol·L-1降至0.06 mol·L-1,则v(NO2)="_______________" mol·(L·min)-1。
(2)若使N2O4的浓度继续由0.06 mol·L-1降至0.036 mol·L-1,若近似用(1)所求得的反应速率计算,后一段反应所需的时间t1为____________ s。
(3)后一段反应实际消耗时间t2____________t1(填“=”“<”或“>”)。
取a mol A和b mol B置于V L容器内,发生可逆反应:a A(g)+bB(g) cC(g)+dD(g),1 min后,测得A的浓度为x mol·L-1,这段时间内反应的平均速率若以物质A的浓度变化来表示,应为____________________________________________________________________。
cC(g)+dD(g),1 min后,测得A的浓度为x mol·L-1,这段时间内反应的平均速率若以物质A的浓度变化来表示,应为____________________________________________________________________。
对于反应:4FeS2+11O2====2Fe2O3+8SO2,当生成SO2的速率为0.4 mol·L-1·s-1时,O2的减少速率为______________,测得4 s 后,O2的浓度为2.8 mol·L-1,则O2的起始浓度为________________。
一个5 L的容器里,盛入8.0 mol某气态反应物,5 min 后测得这种气态反应物还剩余6.8 mol,这种反应物的化学反应速率为___________mol·(L·min)-1。
反应C(s)+H2O(g) CO(g)+H2(g)在一体积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是____________。
CO(g)+H2(g)在一体积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是____________。
①增加C的量②将容器的体积扩大一倍③保持体积不变,充入N2使体系压强增大④保持压强不变,充入N2使容器体积变大