对于反应:4FeS2+11O2====2Fe2O3+8SO2,当生成SO2的速率为0.4 mol·L-1·s-1时,O2的减少速率为______________,测得4 s 后,O2的浓度为2.8 mol·L-1,则O2的起始浓度为________________。
(共8分)新型高能钠硫电池以熔融的钠、硫为电极,以导电的陶瓷为固体电解质。该电池放电时为原电池,充电时为电解池,反应原理为:2Na+xS Na2Sx。
Na2Sx。
(1)放电时Na发生________反应(填:氧化或还原),S作________极
(2)充电时Na所在电极与直流电源的________极相连。
(3)放电时负极反应为_______________________;
(4)用此电池作电源电解饱和NaCl溶液,当阳极产生33.6 L(标准状况)气体时,消耗金属Na的质量为______。
(每空2分,共10分)(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是_____
A、KMnO4 B、 H2O2 C、 Cl2水 D、 HNO3
然后再继续加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+
而不损失CuSO4的目的,调整溶液pH可选用下列中的________
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)向25 mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,得到曲线如下图所示 
①、写出氢氧化钠溶液与醋酸溶液反应的离子方程式
②、该氢氧化钠溶液的物质的量浓度为
③、在B点,a12.5 mL(填“大于”、“小于”或“等于”)
(每空2分,共4分)
(1)对于Ag2S(s)  2Ag+(aq)+ S2-(aq),其Ksp=____________。
2Ag+(aq)+ S2-(aq),其Ksp=____________。
(2)下列说法不正确的是__________。
| A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小; |
| B.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的; |
C.对于Al(OH)3(s) Al(OH)3(aq) Al(OH)3(aq)  Al3++3OH-,前者为溶解平衡,后者为电离平衡; Al3++3OH-,前者为溶解平衡,后者为电离平衡; |
| D.除去溶液中的Mg2+,用OH-比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大 |
E. 沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全。
已知:(X代表卤素原子,R代表烃基)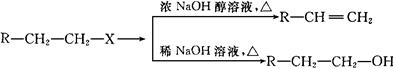
利用上述信息,按以下步骤从 合成
合成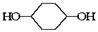 。(部分试剂和反应条件已略去)
。(部分试剂和反应条件已略去)
请回答下列问题:
(1)分别写出B、D的结构简式:B_________、D_________。
(2)反应①~⑦中属于消去反应的是。(填数字代号)
(3)如果不考虑⑥、⑦反应,对于反应⑤,得到的E可能的结构简式为:
。
(4)试写出C D反应的化学方程式(有机物写结构简式,并注明反应条件)
D反应的化学方程式(有机物写结构简式,并注明反应条件)
A、B、C、D四种化合物,有的是药物,有的是香料。它们的结构简式如下所示:

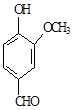

A BCD
(1)化合物A的分子式是;A中含有的官能团的名称是;
(2)A、B、C、D四种化合物中互为同分异构体的是(填序号);
(3)化合物B的核磁共振氢谱中出现组峰;
(4)在溴水中与溴发生加成反应的是(填序号);与三氯化铁溶液反应呈紫色的是(填序号);1mol D最多能与mol的氢气发生加成反应;