在含1 mol复盐NH4Al(SO4)2液中加入Ba(OH)2溶液,若生成l.6 mol BaSO4沉淀,则生成NH3•H2O的物质的量为
| A.0.8mol | B.l mol | C.0.2mol | D.0.4mol |
下图是从NaCl或CsCl晶体结构图中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是()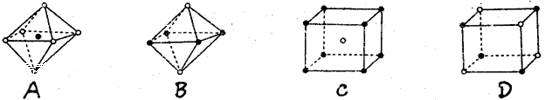
某学生设计了一个“黑笔写红字’’的趣味实验,如图所示.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是()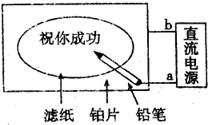
| A.铅笔端作阳极,发生还原反应 | B.铂片端作阴极,发生氧化反应 |
| C.铅笔端有少量的氯气产生 | D.a点是负极,b点是正极 |
在隔绝空气的情况下,9.8g Fe、Mg混合物溶于一定量某浓度的稀HNO3中,当金属完全溶解后,收集到0.2 molNO气体。在反应后的溶液中加入足量的烧碱溶液,可生成氢氧化物沉淀的质量为()
| A.18 g | B.20 g | C.22 g | D.无法计算 |
下图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀铜,接通
上的c点显红色.为实现铁上镀铜,接通 后,使c、d两点短路.下列叙述正确的是()
后,使c、d两点短路.下列叙述正确的是()
| A.a为直流电源的负极 | B.c极发生的反应为2H++2e-=H2↑ |
| C.f电极为铜板 | D.e极发生还原反应 |
为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性。
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加Ag NO3溶液,产生白色沉淀。
根据实验以下推测正确的是
| A.一定有SO32-离子 | B.一定有CO32-离子 |
| C.Cl-离子一定存在 | D.不能确定HCO3-离子是否存在 |