如图1所示是实验室中制取气体的一种简易装置。
(1)请简述检验它的气密性的方法_______________________。
(2)利用如图1所示装置可以制取(填反应物状况及发生反应是否需要的条件)________________________气体。
某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态。请回答有关问题。
(3)已知16.9%稀硝酸的密度为1.10g/cm3,则其物质的量浓度为____________(计算结果保留两位小数)。用若用63%的硝酸配制16.9%稀硝酸500mL,所需的玻璃仪器有玻璃棒、烧杯和 。
(4)当打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是_______________________。B装置烧杯中液体的作用是__________________________________。当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体。
(5)已知下列反应可以发生:Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O,而A装置中的稀硝酸即使换成浓硝酸,也不能生成+6价的铁的化合物,其原因是________。
2K2FeO4+3KNO2+2H2O,而A装置中的稀硝酸即使换成浓硝酸,也不能生成+6价的铁的化合物,其原因是________。
a.HNO3的氧化性比KNO3弱
b.反应的温度不够
c.HNO3的热稳定性比KNO3差
d.FeO42-不能存在于酸性溶液中
(6)现有仪器和药品:试管和胶头滴管,0.1mol/LKSCN溶液、0.2mol/L酸性KMnO4溶液、0.1mol/LKI溶液、氯水等。请你设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告:
| 实验步骤 |
操作 |
现象与结论 |
| 第一步 |
取少量液体装于试管,向试 管中滴入几滴KSCN溶液。 |
|
| 第二步 |
|
若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+。 |
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
Ⅰ.测定过氧化氢的含量
步骤如下并填写下列空白:
(1)将10.00 mL密度为ρ g/mL的过氧化氢溶液稀释至250mL。量取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,作被测试样。此过程中需要用到的定量仪器。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请完成该反应方程
___MnO4- + __H2O2 + ___H+ → ___Mn2+ + __H2O + __ _____
(3) 滴定时,将高锰酸钾标准溶液注入滴定管中,滴定到达终点的现象是
(4)重复滴定二次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为___________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果____(填“偏高”“偏低”“不变”)。
Ⅱ.探究过氧化氢的性质
该化学小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、淀粉碘化钾溶液、二氧化锰,实验仪器及用品可自选。)
请将他们所选的实验试剂和实验现象填入下表:
| 实 验 内 容 |
实 验 试 剂 |
实 验 现 象 |
| 探究氧化性 |
||
| 探究不稳定性 |
(14分)溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
| 苯 |
溴 |
溴苯 |
|
| 密度/g·cm-3 |
0.88 |
3.10 |
1.50 |
| 沸点/℃ |
80 |
59 |
156 |
| 水中溶解度 |
微溶 |
微溶 |
微溶 |

按以下合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL 液溴。向a中滴入几滴液溴,有白雾产生,是因为生成了气体。继续滴加至液溴滴完。装置d中NaOH溶液的作用是。
(2)反应过程中,a外壁温度升高,为提高原料利用率,利用温度计控制温度,适宜的温度范围为(填序号)。
A.>156℃ B. 59℃-80℃ C.<59℃
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是;
③向分离出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是。
(4)经过上述分离操作后,粗溴苯中还含有的主要杂质为,要进一步提纯,下列操作中必须的是(填入正确选项前的字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
胆矾(CuSO4·5H2O)是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。
完成下列各题:
Ⅰ.(1)向含铜粉的稀硫酸中滴加浓硝酸,随着铜粉的溶解可能观察到的实验现象、。
(2)制得的胆矾晶体(CuSO4·5H2O)中可能存在的杂质是(写化学式)。
(3)采用重量法测定CuSO4·5H2O的含量时,步骤如下:
①取样,称量②加水溶解③加氯化钡溶液生成沉淀④过滤(其余步骤省略)
在过滤前,需要检验是否沉淀完全,其操作是。
Ⅱ. 某研究性学习小组用ZRY-1型热重分析仪对12.5克硫酸铜晶体(CuSO4·5H2O)进行热重分析,随温度的升高,硫酸铜晶体依次发生下列反应。
a.CuSO4·5H2O CuSO4+5H2O
CuSO4+5H2O
b.CuSO4 CuO+SO3↑,2SO3
CuO+SO3↑,2SO3 2SO2+O2
2SO2+O2
c.4CuO 2Cu 2 O+O2↑
2Cu 2 O+O2↑
请回答下列问题:
(1)实验过程中热重分析仪测得残留固体质量为3.8 g,试推断该固体的组分是(写化学式),其对应的物质的量之比是。
(2)热重分析仪加热晶体至恒重后,将全部气体导出,通入氢氧化钡溶液充分反应,所得沉淀经过滤、洗涤、干燥,质量为g。
如图所示A管中装有Fe粉和适量的稀H2SO4,B管中装有足量的NaOH溶液。某同学用该装置制Fe(OH)2。完成下列填空:
(1)打开a,使A管中反应进行一段时间。
(2)夹紧止水夹a,在B管中可观察到的现象是:, B中发生反应的离子方程式为。
(3)该同学进行(1)操作的目的。
某研究性学习小组的同学想通过下图实验装置探究SO2与Na2O2反应的产物。(夹持装置已略去,装置的气密性良好)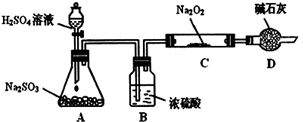
Ⅰ.实验中装置B可吸收水分,干燥SO2气体,其目的是:_________________________。
装置D除了吸收过量的SO2,避免污染空气外,还起到的作用是:_________________。
Ⅱ.对C中固体产物提出如下假设:(假设Na2O2已全部反应)
假设1:__________。 假设2:只有Na2SO4; 假设3:既有Na2SO3又有Na2SO4。
(1)甲同学认为SO2与Na2O2的反应不同于CO2,应为假设2成立,请据此写出C中所发生反应的化学方程式:_____________________。
(2)若假设2成立,为确定C中固体产物的成分,甲同学设计如下实验:
得出结论:C中固体产物只有Na2SO4。该方案是否合理?答:__________。(填“是”或“否”)理由是______________________________。
(3)乙同学为证明假设3成立,设计如下实验。
实验步骤和结论为:
①取少量C中固体产物于试管中,加入适量的蒸馏水溶解;
②滴加过量的1mol•L-1BaCl2溶液,若产生白色沉淀,则证明C中固体产物中有_________;
③滴加适量的1mol•L-1稀盐酸,若白色沉淀部分溶解,并产生刺激性气味气体,则证明C中固体产物中有___________________。