瘤突胡椒具有抗肿瘤和调节血脂功能,其合成路线如下。
回答下列问题:
(1)化合物A中的含氧官能团的名称为________________________。
(2)B→C的反应类型是___________,G→H的反应类型是___________,
(3)写出同时满足下列条件的E的一种同分异构体的结构简式_______________________。
①是苯的同系物的衍生物
②能发生银镜反应,其中一种水解产物也能发生银镜反应
③有四种化学环境不同的氢原子,其数目比为6∶3∶2∶1。
(4)写出B与足量的碳酸钠溶液反应的化学方程式_________________________________。
(5)已知:R1-CH=CH-R2 R1-CHO+R2-CHO。
R1-CHO+R2-CHO。
化合物 是一种合成药物的中间体,请写出以CH2(COOH)2、CH2Cl2及
是一种合成药物的中间体,请写出以CH2(COOH)2、CH2Cl2及 为原料制备该化合物的合成路线流程图(无机试剂任用)。
为原料制备该化合物的合成路线流程图(无机试剂任用)。
(合成路线常用的表示方式为:A B……
B…… 目标产物)
目标产物)
钾是—种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:Na(l)+KCl(l) NaCl(l)+K(g)(正反应吸热)
NaCl(l)+K(g)(正反应吸热)
| 压强(kPa) |
13.33 |
53.32 |
101.3 |
| K的沸点(℃) |
590 |
710 |
770 |
| Ka的沸点(℃) |
700 |
830 |
890 |
| KCl的沸点(℃) |
1437 |
||
| NaCl的沸点(℃) |
1465 |
该反应的平衡常数可表示为:K=c(K),各物质的沸点与压强的关系见上表。
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为,而反应的最高温度应低于。
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是。
(3)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为:K= 。
。
双氧水(H2O2)和水都是极弱的电解质。
(1)若把H2O2看成是二元弱酸,请写出它在水中的电离方程式。
(2)鉴于H2O2显弱酸性,它能同强碱作用形成正盐,在一定条件下也可形成酸式盐,请写出H2O2与Ba(OH)2作用形成正盐的化学方程式:。
(3)水电离生成H3O+和OH-叫做水的自偶电离。双氧水同水一样,也有极微弱的自偶电离,其自偶电离的方程式为。
(4)除了过氧化氢跟碱的反应外,请你再写出一个可表明双氧水是弱酸的反应的化学方程式。
在温度为830°K时,下列可逆反应具有某些特殊性质:CO+H2O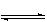 H2+CO2若起始浓度[CO]为2mol/L、[H2O]=
H2+CO2若起始浓度[CO]为2mol/L、[H2O]= 3mol/L,反应达到平衡时,CO的转化率为60%;如果将H2O的起始浓度加大到6mol/L,则CO的转化率为75%。请注意上述有关数据,并总结出规律,完成下列问题:
3mol/L,反应达到平衡时,CO的转化率为60%;如果将H2O的起始浓度加大到6mol/L,则CO的转化率为75%。请注意上述有关数据,并总结出规律,完成下列问题:
设830°K时,起始浓度c(CO)为amol/L、c(H2O)为bmol/L,反应达到平衡时c(H2)为cmol/L。
(1)当b不变时,a减少,重新达到平衡时,CO的转化率,H2O的转化率(填“上升”、“下降”或“不变”)
(2)当a=5,c=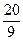 时,b=
时,b=
(3)当a=b时,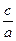 =
=
(4)用以表示a、b、c之间关系的代数式是
(5分) 25℃时,若体积为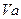 、
、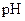 =" a" 的某一元强酸与体积为
=" a" 的某一元强酸与体积为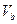 、
、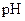 =" b" 的某一元强碱混合,恰好中和,且已知
=" b" 的某一元强碱混合,恰好中和,且已知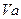 <
<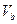 和 a = 0.5b。则:
和 a = 0.5b。则:
(1)a值可否等于3 (填“可”或“否”),其理由是 。
。
(2)a值可否等于5(填“可”或“否”),其理由是。
(3)a 的取值范围__________________________________________________。
从某铝镁合 金片上剪下一小块(质量为1.0g),立即投入到盛有10mL10mol/LNaOH溶液的小烧杯中。
金片上剪下一小块(质量为1.0g),立即投入到盛有10mL10mol/LNaOH溶液的小烧杯中。
(1)自反应开始到反应结束,从小烧杯中可观察到的主要现象。(请依次写出)
(2)开始时产生气泡的速率较慢的原因是。
后来的反应速率相当快的原因是。
(3)写出所形成的原电池的负极材料名称:
电 极反应式:
极反应式:
(4)欲利用该反应来测定合金中铝的含量,还应测定的数据。(请逐一写出)