如图为用酸性氢氧燃料电池为电源进行电解的实验装置示意图。下列说法中,正确的是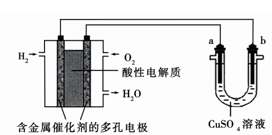
| A.燃料电池工作时,正极反应为:O2 + 4H++ 4e-= 2H2O |
| B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 |
| C.a极是含锌、铁的粗铜,b极是纯铜, a极溶解铜的质量与b极析出铜的质量相等 |
| D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
下列说法不正确的是( )
| A.Ksp只与难溶电解质的性质和温度有关 |
| B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 |
| C.其他条件不变,离子浓度改变时,Ksp不变 |
| D.两种难溶电解质作比较时,Ksp小的,溶解度一定小 |
下列说法中正确的是( )
| A.25℃时,NH4Cl和NH3 .H2O的混合液中离子浓度可能为c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B.向0.1mol/L的CuSO4溶液中加入少量蒸馏水,溶液酸性减弱,Cu2+水解程度降低 |
| C.25℃时,PH=12的NaOH溶液、PH=12的CH3COONa溶液、PH=2的硫酸,三种溶液中水的电离程度相同 |
| D.25℃时,向稀氨水中通入NH3,溶液中c(OH-)减小 |
下列方程式书写正确的是()
| A.HCO3﹣在水溶液中的电离方程式:HCO3﹣+H2O⇌H3O++CO32﹣ |
| B.H2SO3的电离方程式:H2SO3⇌2H++SO32﹣ |
| C.CO32﹣的水解方程式:CO32﹣+2H2O⇌H2CO3+2OH﹣ |
| D.NaHCO3的电离方程式:NaHCO3═Na++H++CO32﹣ |
下列叙述正确的是( )
| A.某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| B.在滴有酚酞的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 |
| C.常温下,1.0×10-3 mol·L-1盐酸的pH=3.0,1.0×10-8 mol·L-1盐酸的pH=8.0 |
| D.常温下,若1 mL pH=1的盐酸与100 mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 |
物质的量浓度相同的下列溶液,NH4+浓度最大的是( )
| A.NH4Cl | B.NH4HSO4 | C.CH3COO NH4 | D.NH4HCO3 |