氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义。
(1)合成氨的原理为:N2(g)+3H2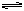 2NH3 △H=" -" 92.4kJ/mol
2NH3 △H=" -" 92.4kJ/mol
①将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,平衡时测得N2为0.1 mol,H2为0.3 mol,NH3为0.1 mol。该条件下H2的转化率为 。
此温度下该反应的平衡常数K= 。
②欲提高H2的转化率,下列措施可行的是 。
a.向容器中按原比例再充入原料气
b.向容器中再充入惰性气体
c.改变反应的催化剂
d.液化生成物分离出氨
(2)在2L密闭容器中,800℃时反应2NO(g)+O2(g)  2NO2(g) △H<0体系中,各成分浓度随时间的变化如图:
2NO2(g) △H<0体系中,各成分浓度随时间的变化如图: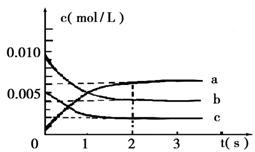
①用O2表示从0~2s内该反应的平均速率v=___________。
②能说明该反应已经达到平衡状态的是_________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变
③为使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
(3)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是______(填代号)。
4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是______(填代号)。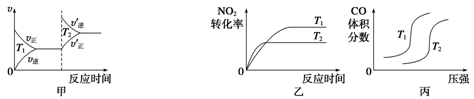
某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、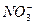 、
、 、
、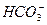 、Cl-等,取该溶液进行如下实验:
、Cl-等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
(1)在实验①中,下图所示的操作中正确的是________________(填代号)。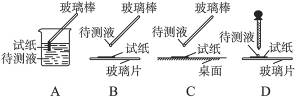
(2)根据上述实验判断原溶液中肯定存在的离子是______________________,肯定不存在的离子是___________________。
(3)写出与②和③两个实验有关的离子方程式:
②____________________________________________,
③____________________________________________。
(1)在浓硝酸中放入铜片。
①开始反应的化学方程式为__________________________________。
②若铜有剩余,则反应将要结束时的反应方程式是______________________________。
③等反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因是
_______________________________________________________________________________。
(2)在100 mL混合酸中,c(HNO3)="0.4" mol·L-1,c(H2SO4)="0.2" mol·L-1,向其中加入2.56 g铜粉,微热,等充分反应后,溶液中Cu2+的物质的量浓度为__________________________。
(3)14 g铜银合金与一定量某浓度的硝酸溶液反应,将放出的气体与1.12 L(标准状况下)氧气混合通入水中,恰好全部被水吸收,则合金中铜的质量是_________________g。
GaAs是仅次于硅的一种新型化合物半导体材料,其性能比硅更优越。Ga位于周期表的第ⅢA族,As位于周期表的第ⅤA族。
(1)Ga和As的最外层电子数分别是_____________________________________________。
(2)GaAs中Ga和As的化合价分别是___________________________________________。
(3)第ⅣA族的C和Si也可以形成类似的化合物半导体材料,该化合物半导体材料的化学式可表示为__________________。
下图表示NH4NO3和D物质为初始反应物发生的一系列变化,其中,在常温下B为液态,F为不溶于水但可溶于酸的白色固体,G与I为无色气体,G能使湿润的红色石蕊试纸变蓝。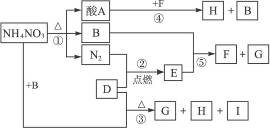
(1)D和H的化学式:D_____________,H_____________,G与E的电子式:G_____________, E_____________。
(2)写出下列反应的方程式:反应①_____________;反应②_____________。
氮可以形成多种离子,如N3-、 、
、 、
、 、
、 、
、 等,已知
等,已知 与
与 是由中性分子结合质子形成的,有类似于
是由中性分子结合质子形成的,有类似于 的性质,另外氮与氢也能形成NH3、N2H4、N3H5、N4H6、N5H7……
的性质,另外氮与氢也能形成NH3、N2H4、N3H5、N4H6、N5H7……
(1)一个 含有__________________________个电子,
含有__________________________个电子, 的电子式为____________。
的电子式为____________。
(2)形成 的中性分子的结构式是_____________________。
的中性分子的结构式是_____________________。
(3) 在强碱溶液中反应的离子方程式:_____________________________。
在强碱溶液中反应的离子方程式:_____________________________。
(4)NH3、N2H4、N3H5、N4H6、N5H7是否互为同系物,为什么?__________________________。
(5)写出N5H7可能的结构简式______________________________。
(6)这一系列化合物中N的质量分数最大值应小于____________%。