有甲、乙、丙三瓶等体积等物质的量浓度的NaOH溶液,若将甲蒸发掉一半水分,在乙中通入少量的CO2,丙不变,然后分别向甲、乙、丙三瓶中加入同浓度的盐酸,完全反应后所需盐酸溶液的体积是 ( )
| A.甲=丙>乙 | B.丙>乙>甲 | C.乙>甲=丙 | D.甲=乙=丙 |
实验室里需要配制480mL 0.10mol·L-1的硫酸铜溶液,下列实验方案及实验操作正确的是()
| 容量瓶容积 |
溶质质量 |
实验操作 |
|
| A |
480mL |
硫酸铜:7.68g |
加入 500mL水 |
| B |
480mL |
胆矾:12.0g |
配成500mL溶液 |
| C |
500mL |
硫酸铜:8.0g |
加入500mL水 |
| D |
500mL |
胆矾:12.5g |
配成500mL溶液 |
下列物质溶于水时会破坏水的电离平衡,且属于电解质的是()
| A.氯气 | B.醋酸钠 | C.碘化钾 | D.二氧化碳 |
下列实验装置或操作与粒子的大小无直接关系的是 ( )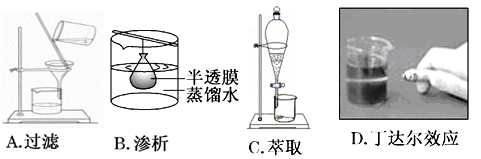
下列说法正确的是
| A.赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的 |
| B.海洋经济专属区的资源开发可获得Na、Ca、K、Mg、B等金属 |
| C.电解MgCl2饱和溶液,可制得金属Mg |
| D.从海带中提取碘单质的过程不涉及氧化还原反应 |
下列叙述正确的是()
| A.某元素从化合态变为游离态时,该元素可能被还原,也可能被氧化 |
| B.在氧化还原反应中,可通过比较失去电子数的多少确定还原剂的强弱 |
| C.氧化还原反应的本质是电子得失 |
| D.有单质参加或生成的化学反应不一定是氧化还原反应 |