图1是A、B、C三种固体物质的溶解度曲线图,请结合图示回答下列问题: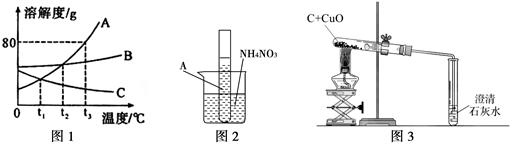
(1)t2℃时,A、B、C三种物质的溶解度大小关系是 。
(2)t3℃时,将30gA物质加入到50g水中,充分溶解后,所得溶液是 (选填“饱和”或“不饱和”)溶液。
(3)室温下,将盛有A的饱和溶液的试管放入盛水的烧杯中,再向烧杯内的水中加入一定量的NH4NO3并搅拌(如图2),试管内可以观察到的现象是 。
水对于我们的生产和生活都是非常重要的。
(1)图①所示电解水的实验中,试管(填“1”或“2”)中收集的气体是氧气。
(2)小刚要净化收集的雨水,自制了一个简易净水器(如图②所示),其中小卵石、石英沙和膨松棉的作用是。
(3)某塑料瓶装矿泉水标签如图③所示,饮用该矿泉水,可以为人体提供_________种营养素。塑料瓶轻便卫生,可回收再利用。其所用材料不属于。
A. 合成材料 B.有机高分子 C.有机物 D.合金
(4)我们应当珍惜每一滴水,下列做法不利于节约用水的是。
A.洗菜的水用来浇花B.使用节水龙头
C.用不间断的流水冲洗碗筷 D.洗手擦肥皂时,关上水龙头
下列字母表示的各种物质是初中化学常见的不同物质。其中A、B、C、D存在如图所示的转化关系(其中“→”表示可以进行转化),四种物质中均含有两种相同的元素。
(1)B是纯碱,其化学式为。
(2)X是由三种元素组成的酸,请写出X与B反应生成D、Y和Z的化学方程式。
(3)A在受热时可以分解生成B、Y和Z,那么A的化学式为。
(4)向A的溶液中加入C的溶液,可以生成B和Z,请写出该化学方程式。
(5)从上述物质中选2种为一组,按下图所示装置进行实验。将胶头滴管中的液体滴入瓶中,看到烧杯中的澄清石灰水变浑浊。写出符合要求的两组物质。
| 物质 序号 |
液体 |
固体 |
| ① |
||
| ② |

(6)请根据以上七种物质分析,下列说法正确的是。
a.X与A、B、C反应均有气泡冒出 b.七种物质中A、B、D属于盐类
c.Y与C反应可以生成B和Zd.X、Y、Z的相对分子质量依次减小
溶液的组成和配制是初中化学中的重要知识,在生产生活中有广泛的应用。
(1)右图为氯化钠、硝酸钾在水中的溶解度曲线。
氯化钠溶液中的溶剂是。20℃时,硝酸钾的溶解度约为g。30℃时,硝酸钾的溶解度氯化钠的溶解度。(填 “大于”、“小于”或“等于”)
(2)某学校化学兴趣小组用不纯的氯化钠固体(含有的杂质CaO)来配制一定溶质质量分数的NaCl溶液,实验的流程图如下:
①溶液A中的溶质为。
②操作II的名称是。
③过量稀盐酸加入到溶液B中所发生反应的化学方程式为。
铁、铜是我们生活中常见的金属。
(1)下列生活用品中,铁锅用来做饭是利用了铁的性,铜丝作导线是利用了铜的性。
(2)根据右侧转化关系图,回答问题。
①铁生锈的条件是。
②写出步骤II中的化学方程式。
③黄色溶液中的溶质是。
将宏观、微观及化学符号联系在一起是化学学科的特点。
(1)A、B、C、D表示四种物质,其微观示意图如下所示:
①从微观角度看,A图表示3(填化学符号),B中每个分子由个原子构成。
②从宏观角度看,图中表示混合物的是(填字母序号,下同),表示单质的是。
(2)在一定条件下,A和B能发生化学反应生成E和F,其微观示意图如下所示:
①若F为空气中体积分数最大的气体,则该反应中生成的E和F的质量比。
②若F为氧化物,且A和B的分子个数比为5:4,则该反应的化学方程式为。