在NO2、HBr、SO2和NH3四种气体中,有颜色的气体是 ;在相同条件下,密度最小的气体是 ;能使润湿的红色石蕊试纸变蓝的气体是 ;两气体相遇冒白烟,这两种气体是 。
(本题共8分)二氧化碳和氢气在一定条件下可以制得烯烃,该技术已成为节能减碳的有效途径之一。已知二氧化碳和氢气按1:3比例可合成烯烃B, B的产量是衡量一个国家石油化工水平的标志。下图是合成橡胶和TNT的路线。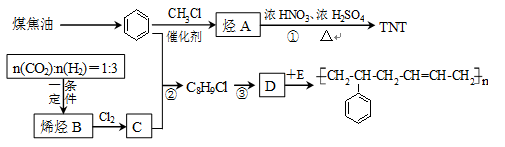
已知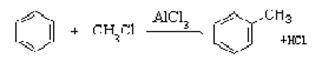
工业上由煤焦油提取苯的操作名称为_______。E的结构简式为__________________。
写出反应类型:反应②________________;反应③__________________。
写出反应D+E的化学方程式_______________________。
D在一定条件下与足量H2反应后的产物,其一氯代物有_________种。
(本题共16分)碳纳米管是近年来发展迅速的一种具有特殊结构及优异性能的纳米材料。它是由碳原子形成的无缝、中空管体材料,主要由五边形、六边形的碳环组成,相当于石墨结构卷曲而成,结构如下。
写出一种与碳纳米管互为同素异形体物质____________。
储氢纳米碳管研究成功体现了科技的进步。但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应式为:
C + K2Cr2O7 + H2SO4→ CO2 + K2SO4 + Cr2(SO4)3 + H2O
配平上述化学方程式并标出电子转移方向与数目;此反应的被还原的元素是 ,氧化产物是 ;
H2SO4在上述反应中表现出来的性质是 (填选项编号)
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
上述反应若产生0.1mol CO2气体,则转移电子的物质的量是 mol。
NaNO2有像食盐一样的外观和咸味,它可将正常的血红蛋白变为高铁血红蛋白,使血红蛋白中的铁元素由二价变为三价,失去携氧能力,美蓝是亚硝酸盐中毒的有效解毒剂。下列说法正确的是 (填序号)。
| A.解毒剂美蓝应该具有氧化性 | B.中毒时亚硝酸盐发生氧化反应 |
| C.解毒时高铁血红蛋白被还原 | D.中毒过程中血红蛋白显氧化性 |
已知NaNO2能发生如下反应:NaNO2+HI →NO+I2+NaI+H2O (未配平), 从上述反应推知 (填序号)。
| A.氧化性:I2>NaNO2 | B.氧化性:NaNO2>I2 |
| C.还原性:HI>NO | D.还原性:I2>HI |
根据上述反应,可用试纸和生活中常见的物质进行实验来鉴别NaNO2和NaCl。现供选用的物质有:①白酒 ②碘化钾淀粉试纸 ③淀粉 ④白糖 ⑤食醋,进行本实验时,可以选用的物质至少有 (填序号)。
某工厂的废液中含有2%~5%的NaNO2,直接排放会造成污染。下列试剂中:①NaCl ② NH4Cl ③HNO3④浓H2SO4,能使NaNO2转化为N2的是 (填序号)。
(本题共8分)阻燃剂又称防火剂,主要用于延迟或防止可燃物的燃烧。根据组成,阻燃剂可分为卤系阻燃剂、无机阻燃剂等。卤系阻燃剂多为有机氯化物和有机溴化物,受热会分解产生卤化氢(HX),起到阻燃作用。卤化氢的电子式为________;氯离子的结构示意图为________。
下列能说明氯的非金属性强于溴的事实是________(选填编号)。
a.HClO酸性强于HBrO
b.稳定性:HBr小于HCl
c.在二者形成的化合物BrCl 中氯显负价,溴显正价
无机阻燃剂中,氢氧化铝和氢氧化镁两种阻燃剂占据着重要位置。两者的阻燃机理都是在达到热分解温度时迅速分解为氧化物与水,起到吸热降温的作用。写出氢氧化铝在酸性溶液中的电离方程式_________ 。
写出氢氧化铝与氢氧化钠反应的离子方程式_______________。无水碳酸镁也是一种新型无机阻燃剂,除了具有单位质量吸热量更大的特点外,还能释放具有灭火作用的气体。写出该气体的结构式_______________。与镁离子核外电子排布相同的另外两个阳离子的半径大小关系为________(填微粒符号)。
假定元素周期表是有限的,根据已知的元素周期表的某些事实和理论可归纳出一些假说。
(1)已知元素周期表中的各周期可排元素种类如下:
| 周期 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
| 元素种类 |
2 |
8 |
8 |
18 |
18 |
32 |
32 |
人们预测元素周期表第八周期将来也会排满,那么该周期排满后的元素种数是 。
A.18 B.32 C.50 D.无法判断
(2)根据周期表中每个周期非金属元素的种数(把稀有气体元素看做非金属元素),预测周期表中应该有 种非金属元素,还有 种未发现。未发现的非金属元素处于 周期 族。
(3)小明同学所在的化学探究小组,在查阅相关资料后归纳出元素周期表的另一种画法——三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置。
回答下列问题:
①请在图中将过渡元素所在的位置涂黑。
②画出B元素价电子排布图 。
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为 ,该元素的符号为 ;
(2)Y元素原子的价层电子的电子排布图为 ,该元素的名称是 ;
(3)比较X的氢化物与同族第二、三周期元素所形成的氢化物稳定性 。