已知Fe2+与K3[Fe(CN)6]溶液反应呈蓝色。某同学进行如下图的实验,将左铁棒的上、下两端各联上一锌片,而在右铁棒中段联上一铜片(如图1),并将它们同时静置于含有K3[Fe(CN)6]及酚酞的混合胶质溶液中。经一段时间后,发现图中的甲、乙、丙、丁、戊、己等六区均有变化(如图2)。下列关于各区变化情况的判断,正确的是( )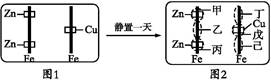
| A.甲区呈现蓝色 | B.乙区呈现红色 |
| C.戊区产生Cu2+离子 | D.丁区产生Fe3+离子 |
对下列有机反应类型的认识中,错误的是
下列说法不正确的是
| A.乙醇和乙酸分子中都含有C=O键 |
| B.乙烯分子中含有碳碳双键 |
| C.乙酸能使紫色石蕊试液变红而乙醇则不能 |
| D.甲烷与氯气在光照条件下能发生取代反应 |
对于化学反应中的能量变化,表述正确的是
| A.中和反应是吸热反应 | B.燃烧属于放热反应 |
| C.断开化学键的过程会放出能量 | D.加热才能发生的反应一定是吸热反应 |
下列离子方程式,书写正确的是
| A.钠投入水中:Na+H2O=Na++OH-+H2↑ |
| B.硫酸氢钠溶液与NaOH溶液混合:H++OH-=H2O |
| C.氢氧化钡溶液和稀硫酸混合:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| D.盐酸与石灰石反应制备二氧化碳:CO32-+2H+=CO2↑+H2O |
对于反应2H2O2=2H2O+O2↑,下列措施不能增大化学反应速率的是
| A.减小H2O2溶液的浓度 | B.升高H2O2溶液的温度 |
| C.向H2O2溶液中加入少量MnO2粉末 | D.向H2O2溶液中加入一定浓度的FeCl3溶液 |