下列实验设计及其对应离子方程式均正确的是( )
| A.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+===Cu2++2Fe2+ |
| B.Na2O2与H2O反应制备O2:Na2O2+H2O===2Na++2OH-+O2↑ |
| C.将氯气溶于水制备次氯酸:Cl2+H2O===2H++Cl-+ClO- |
D.用浓盐酸酸化的KMnO4与H2O2反应,证明H2O2具有还原性:2MnO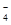 +6H++5H2O2===2Mn2++5O2↑+8H2O +6H++5H2O2===2Mn2++5O2↑+8H2O |
下列物质的化学式中,具有非极性键的离子化合物是
| A.Na2O | B.MgF2 | C.NaOH | D.Na2O2 |
决定金属性强弱的是
| A.1个金属原子失去电子的多少 | B.1mol金属与酸反应放出H2的多少 |
| C.1mol金属失去电子的多少 | D.金属原子失去电子的难易程度 |
下列说法不正确的是
| A.含有共价键的化合物一定是共价化合物 |
| B.在共价化合物中一定含有共价键 |
| C.含有离子键的化合物一定是离子化合物 |
| D.双原子单质分子中的共价健一定是非极性键 |
2007年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究。下列关于 Pt的说法正确的是
Pt的说法正确的是
A. Pt和 Pt和 Pt的质子数相同,互称为同位素 Pt的质子数相同,互称为同位素 |
B. Pt和 Pt和 Pt的中子数相同,互称为同位素 Pt的中子数相同,互称为同位素 |
C. Pt和 Pt和 Pt的核外电子数相同,是同一种核素 Pt的核外电子数相同,是同一种核素 |
D. Pt和 Pt和 Pt的质量数不同,不能互称为同位素 Pt的质量数不同,不能互称为同位素 |
两种金属粉末的混合物52g,溶于足量的稀H2SO4中,生成标准状况下的氢气22.4L,则这种混合物不可能是
| A.Na和K | B.Mg和Al | C.Cu和Al | D.Al和Fe |