常温下,0.1 mol·L-1某一元酸HA溶液中 =1×10-12,下列说法中正确的是( )
=1×10-12,下列说法中正确的是( )
| A.溶液中由水电离出的c(H+)=1×10-10 mol·L-1 |
B.溶液中存在HA H++A- H++A- |
| C.与0.1 mol·L-1 NaOH溶液等体积混合后所得溶液为中性 |
| D.原溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大 |
甲、乙两烧杯中分别盛有10mL 1mol·L-1AlCl3溶液,在甲烧杯中加入一定量NaOH溶液;乙烧杯中加入与上述NaOH溶液等体积、等pH的氨水。下列有关两个烧杯的说法中,正确的是()
| A.甲中产生的沉淀一定比乙中多 |
| B.乙中产生的沉淀一定比甲中多 |
| C.甲和乙产生的沉淀一定一样多 |
| D.甲和乙中产生的沉淀可能一样多 |
对下列各溶液中,微粒的物质的量浓度关系表述正确的是()
A.0.1mol·L-1的(NH4)2SO4溶液中: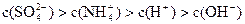 |
B.0.1mol·L-1的NaHCO3溶液中: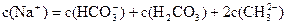 |
C.将0.2mol·L-1NaA溶液和0.1mol·L-1盐酸等体积混合所得碱性溶液中: |
D.在25°C100mLNH4Cl溶液中: |
下列表示溶液中所发生反应的离子方程式正确的是()
| A.向Ba(OH)2溶液中加入稀H2SO4溶液:Ba2++OH-+H++SO2-4===BaSO4↓+H2O |
| B.将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O====SO2-3+2HClO |
| C.碳酸钙与醋酸反应:CaCO3+2H+===Ca2++CO2↑+H2O |
| D.FeSO4溶液中加入H2O:4Fe2++2H2O2+4H+===4Fe3++4H2O |
分类是学习和研究化学的一种常用的科学方法。下列分类合理的()
①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素
④根据反应的热效应将化学反应分为放热反映和吸热反应
⑤根据分散系的稳定性大小将混合物分为胶体、溶液和浊液
| A.只有②④ | B.只有②③⑤ | C.只有①②④ | D.只有②③⑤ |
在下列给定条件的各溶液中,一定能大量共存的离子组是()
| A.含有0.1mol·L-1Fe3+的溶液中:K+、Mg2+、I-、NO-3 |
| B.室温下,pH=1溶液中:Na+、Fe3+、NO-3、SO2-4 |
| C.加入Al能放出H2的溶液中:NH+4、SO2-4、Cl-、HCO-3 |
| D.由水电离的c(OH)-=10-13mol·L-1的溶液中:Ba2+、Cu2+、Cl-、NO-3 |