25 ℃时,水的电离达到平衡:H2O H++OH-,下列叙述中正确的是( )
H++OH-,下列叙述中正确的是( )
| A.将纯水加热到95 ℃时,KW变大,pH不变,水仍呈中性 |
| B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,KW变小 |
| C.向纯水中加入少量固体碳酸钠,c(H+)减小,KW不变,影响水的电离平衡 |
| D.向纯水中加入醋酸钠或盐酸,均可抑制水的电离,KW不变 |
核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪种原子不能产生NMR现象
A.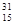 P P |
B.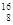 O O |
C. N N |
D. C C |
现在,人们已经知道,原子是由原子核与核外电子构成的。不过,人类对原子结构的认识是逐渐深入的,下列哪位是最先发现电子的科学家
| A.玻尔 | B.卢瑟福 | C.汤姆生 | D.道尔顿 |
胶体区别于其他分散系最本质的特征是
| A.外观澄清透明 | B.胶体有丁达尔效应 |
| C.不稳定 | D.分散质粒子直径在10-9--10-7m之间 |
分类法是一种行之有效、简单易行的科学方法。下列关于“Na2CO3”的分类错误的是
| A.Na2CO3俗名为纯碱,故它属于碱类 | B.Na2CO3属于化合物 |
| C.Na2CO3属于强电解质 | D.Na2CO3属于含氧酸盐 |
2012年“六·五”世界环境日中国主题为“绿色消费 你行动了吗?”,旨在强调绿色消费的理念,唤起社会公众转变消费观念和行为,节约资源能源,保护生态环境。下列有关绿色消费的说法不正确的是
| A.提倡骑自行车或乘公交车上下班 | B.将煤液化或气化,获得清洁燃料 |
| C.推广使用无磷洗衣粉和无氟冰箱 | D.提倡使用一次性木筷 |