丙酸的结构为CH3—CH2—COOH,丙酸盐是安全有效的防霉、防腐剂,一种以碱式碳酸锌为原料的生产工艺流程如下:
| 序号 |
n(丙酸)∶ n(碱式碳酸锌) |
反应温度/℃ |
丙酸锌产率/% |
| 1 |
1∶0.25 |
60 |
67.2 |
| 2 |
1∶0.25 |
80 |
83.5 |
| 3 |
1∶0.25 |
100 |
81.4 |
| 4 |
1∶0.31 |
60 |
89.2 |
| 5 |
1∶0.31 |
80 |
90.1 |
| 6 |
1∶0.31 |
100 |
88.8 |
(1)探究本实验中最佳工艺条件(见上表):反应时间2 h,用水量45 g,n(丙酸)∶n(碱式碳酸锌)=1∶ ,反应温度 ℃。
,反应温度 ℃。
(2)本工艺采用“闭路循环”方式,除具有制备工艺简便、产率高外,还具有 的优点。
(3)某次实验时,将37.0 g丙酸溶于220 mL水中,按上述流程在上述优化的条件下制备,最终得丙酸锌49.6 g,则该次实验丙酸锌的产率为 (写出计算过程)。
(1)甲同学用一种标准盐酸去测定一种未知浓度的氨水溶液的浓度,应选用___①___作指示剂,滴定终点溶液颜色变化__②___,若用待测液润洗锥形瓶,则所测的氨水溶液浓度(以下用偏高,偏低,无影响填空)___③__,若酸式滴定管在用蒸馏水洗净后没有用标准盐酸润洗,则所测氨水的溶液浓度__④___,若酸式滴定管滴定前读数正确,滴定后俯视读数,则所测氨水的溶液浓度__⑤___。
(2)PH相同的盐酸和硫酸溶液分别用蒸馏水稀释至原来的m 倍和n倍,稀释后两溶液的PH仍相同,则m __①___ n(选填> 、< 、 =),若改用PH相同的氨水和氢氧化钠溶液溶液,进行上述操作,则m __②___ n(选填 > 、< 、 =)。
已知由短周期元素组成的A、B、C、D四种化合物所含原子数目依次为2、3、4、5,其中A、B、C含有18个电子,D含有10个电子。请回答
(1)A、B、D的化学式分别是A;B;D
(2)已知8gD与O2完全反应,生成稳定化合物时放出445kJ的热量,写出反应的热化学方程式
(3)若C为第一和第二周期元素组成的化合物。①C的溶液中加入少量的二氧化锰,有无色气体生成,写出化学方程式
②C的溶液中加入足量二氧化锰和稀硫酸,二氧化锰逐渐溶解生成Mn2+,反应中二氧化锰做剂
③当C分别发生①和②两个反应时,若都有1molC完全反应,①和②两个反应中转移电子数之比是:
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示S形成硫酸酸雨的反应方程式 , 。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是 。
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣),n(HSO3﹣)变化关系如下表:
| n(SO3²﹣):,n(HSO3﹣) |
91:9 |
1:1 |
1:91 |
| PH |
8.2 |
7.2 |
6.2 |
①上表判断NaHSO3溶液显 性,用化学平衡原理解释:
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母): 

(4)当吸收液的pH降至约为6时,送至电解槽再生。再生示意图如下: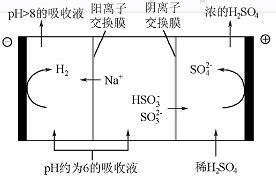
①HSO3-在阳极放电的电极反应式是 。
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用。简述再生原理:
。
某化学兴趣小组为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
| 编号 |
电极材料 |
电解质溶液 |
电流计指针偏转方向 |
| 1 |
Mg、Al |
稀盐酸 |
偏向Al |
| 2 |
Al、Cu |
稀盐酸 |
偏向Cu |
| 3 |
Al、C(石墨) |
稀盐酸 |
偏向石墨 |
| 4 |
Mg、Al |
氢氧化钠溶液 |
偏向Mg |
| 5 |
Al、Zn |
浓硝酸 |
偏向Al |
试根据表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极(正极或负极)是否相同(填“相同”或“不相同”)________。
(2)对实验3完成下列填空:
①铝为________极,电极反应式:______________________________。
②石墨为________极,电极反应式:___________________________。
③电池总反应式:______________________________________。
(3)实验4中铝作负极还是正极________,理由是__________________________
写出铝电极的电极反应式_________________________________。
(4)解释实验5中电流计指针偏向铝的原因:_____________________________。
反应m A+n B p C在某温度下达到平衡。
p C在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是_____________。
②若C为气体,且m+ n = p,在加压时化学平衡发生移动,则平衡必定向______方向移动。
③如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为_____态。