从樟科植物枝叶提取的精油中含有下列甲、乙、丙三种成分:
(甲)
| 分子式 |
C9H8O |
| 部分性质 |
能使Br2/CCl4褪色 |
(乙)
| 分子式 |
C16H14O2 |
| 部分性质 |
能使Br2/CCl4褪色 |
| 能在稀硫酸中水解 |
(丙)
(1)甲中所含官能团的名称为 、 。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
甲
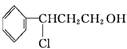
 Y
Y 乙
乙
其中反应Ⅰ的反应类型为 ,反应Ⅰ的目的是 。
(3)已知:
RCH CHR'
CHR' RCHO+R'CHO;2HCHO
RCHO+R'CHO;2HCHO HCOOH+CH3OH
HCOOH+CH3OH
由乙制丙的一种合成路线图如下(A~F均为有机物,图中Mr表示相对分子质量):
①下列物质不能与C反应的是 (选填序号)。
A.金属钠 B.HBr C.Na2CO3溶液 D.乙酸
②写出由E生成F的反应方程式: 。
③D有多种同分异构体,写出其中一种能同时满足下列条件的异构体结构简式 。
a.苯环上连接着三种不同官能团
b.能发生银镜反应
c.能与Br2/CCl4发生加成反应
d.遇FeCl3溶液显示特征颜色
④写出丙的结构简式: 。
(14分)质子交换膜燃料电池广受关注。
(1)质子交换膜燃料电池中作为燃料的H2通常来自水煤气。
已知:①C(s)+1/2O2(g)="CO(g)" △H1=-110.35kJ/mol;
②2H2O(l)=2H2(g)+ O2(g)△H2=+571.6kJ/mol
③H2O(l)=H2O(g)△H3=+44.0kJ/mol
则:C(s)+H2O(g)=CO(g)+H2(g)△H4=。
(2)燃料气(流速为1800mL•h-1;体积分数为:50%H2,0.98%CO,1.64%O2,47.38%N2)中的CO会使电极催化剂中毒,使用CuO/CeO2催化剂可使CO优先氧化而脱除。
①160℃、CuO/CeO2作催化剂时,CO优先氧化反应的化学方程式为。
②灼烧草酸铈[Ce2(C2O4)3]制得CeO2的化学方程式为。
③在CuO/CeO2催化剂中加入不同的酸(HIO3或H3PO4),测得燃料气中CO优先氧化的转化率随温度变化如图所示。
加入(填酸的化学式)的CuO/CeO2催化剂催化性能最好。催化剂为CuO/CeO2-HIO3,120℃时,反应1小时后CO的体积为mL。
(3)下图为甲酸质子交换膜燃料电池的结构示意图。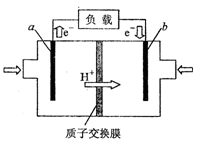
该装置中(填“a”或“b”)为电池的负极,负极的电极反应式为。
(15分)草酸镍晶体(NiC2O4•2H2O)可用于制镍催化剂,硫酸镍晶体(NiSO4•7H2O)主要用于电镀工业。某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下: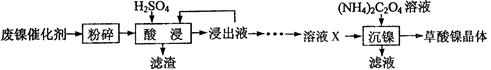
已知:①相关金属离子生成氢氧化物沉淀的pH如下表(开始沉淀的pH按金属离子浓度为1.0 mol•L-1计算):
②Ksp(CaF2)= 1.46×10-10 Ksp(CaC2O4)= 2.34×10-9
(1)粉碎的目的是。
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图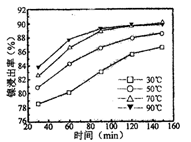
“酸浸”的适宜温度与时间分别为(填字母)。
| A.30℃、30min | B.90℃、150min |
| C.70℃、120min | D.90℃、120min |
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是。
(4)将“沉镍”工序得到的混合物过滤,所得固体用乙醇洗涤、110℃下烘干,得草酸晶体。
①用乙醇洗涤的目的是;
②烘干温度不超过110℃的原因是。
(5)由流程中的“浸出液”制备硫酸镍晶体的相关实验步骤如下:
第1步:取“浸出液”,,充分反应后过滤,以除去铁、铝元素;
第2步:向所得滤液中加入适量NH4F溶液,充分反应后过滤,得“溶液X”;
第3步:,充分反应后过滤;
第4步:滤渣用稍过量硫酸充分溶解后,蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得硫酸镍晶体。
①请补充完整相关实验步骤(可选试剂:H2SO4溶液、NaOH溶液、HNO3溶液、H2O2溶液)
②第2步中加入适量NH4F溶液的作用是。
(12分)某科研小组在900℃的空气中合成出化学式为La2Ca2MnOx的超导体材料,其中La以+3价存在。为确定x的值,进行如下分析:
步骤1:准确称取0.5250g超导体材料样品,放入锥形瓶中,加25.00mL0.06000mol•L-1Na2C2O4溶液(过量)和25mL6mol•L-1HNO3溶液,在60-70℃下充分摇动,约半小时后得到无色透明溶液A(该条件下,只有Mn元素被还原为Mn2+,Na2C2O4被氧化为CO2)。
步骤2:用0.02000mol•L-1KMnO4溶液滴定溶液A至终点,消耗10.00mL KMnO4溶液。
(1)步骤1反应后溶液中Mn2+的物质的量浓度为0.02000mol•L-1。常温下,为防止Mn2+形成Mn(OH)2沉淀,溶液的pH的范围为[已知Mn(OH)2的Ksp=2.0×10-13]
(2)步骤2滴定终点的现象是。
(3)步骤2滴定终点读数时俯视刻度,其他操作都正确,则所测x的值将(填“偏大”、“偏小”或“不变”)。
(4)求x的值(写出计算过程)。
(15分)葛根大豆苷元(F)用于治疗高血压引起的头疼、突发性耳聋等症,其合成路线如下: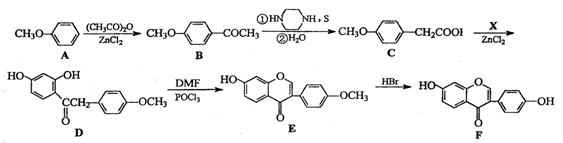
(1)化合物C中的含氧官能团有 、 (填官能团名称)
(2)已知:C→D为取代反应,其另一产物为H2O,写出X的结构简式:
(3)反应E→F的反应类型是
(4)写出同时满足下列条件的B的两种同分异构体的的结构简式: 。
Ⅰ.属于芳香族化合物,分子中有4种不同化学环境的氢;
Ⅱ.能与FeCl3溶液发生显色反应;
Ⅲ.不能发生水解反应,能发生银镜反应。
(5)根据已有知识并结合相关信息,写出以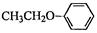 和(CH3CO)2O为原料制备药物中间体
和(CH3CO)2O为原料制备药物中间体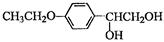 的合成路线流程图(无机试剂任
的合成路线流程图(无机试剂任
用)。合成路线流程图示例如下: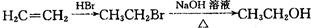
(12分)聚合硫酸铁铝(PFAS)是一种新型高效水处理剂。利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源、粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为铝源,制备PFAS的工艺流程如下: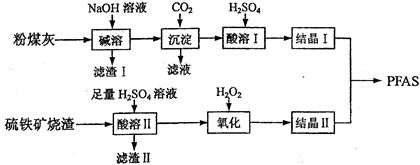
(1)“碱溶”时,Al2O3发生反应的化学方程式为。
(2)“酸溶Ⅱ”时,Fe3O4发生反应的离子方程式为。
(3)“滤渣Ⅰ”、“滤渣Ⅱ”在本流程中能加以利用的是。
(4)“氧化”时应控制温度不超过57℃,其原因是。
(5)“氧化”时若用酸性高锰酸钾溶液代替,发生反应的离子方程式是。
(6)酸度对絮凝效果和水质有显著影响。若产品中残留过多,使用时产生的不良后果是