短周期元素甲、乙、丙、丁、戊的原子序数依次增大,甲是周期表中原子半径最小的元素,乙形成的气态氢化物的水溶液呈碱性,乙与丁同族,丙、丁、戊同周期,丙单质可制成半导体材料,戊的最高化合价为+7,则 ( )。
| A.原子半径:乙>丁>丙 |
| B.非金属性:丙>丁>戊 |
| C.甲与戊形成的化合物是共价化合物 |
| D.乙、丙、丁最高价氧化物对应的水化物均是强酸 |
制造太阳能电池需要高纯度的硅,工业上制高纯度硅常用以下反应来实现:(1)Si(粗)+3HCl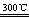 SiHCl3+H2,(2)SiHCl3+H2
SiHCl3+H2,(2)SiHCl3+H2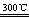 Si+3HCl.对上述两个反应的下列叙述中,错误的是( )
Si+3HCl.对上述两个反应的下列叙述中,错误的是( )
| A.两个反应都是置换反应 |
| B.两个反应中的H2均为还原剂 |
| C.两个反应的条件不同 |
| D.两个反应都是氧化还原反应 |
香烟烟雾中含有CO、CO2、SO2、H2O等气体.用a.无水硫酸铜、b.澄清石灰水、c.红热氧化铜、d.生石灰、e.酸性品红溶液等可将其一一检出,检出的正确顺序是( )
| A.混合气→a→e→b→a→d→c |
| B.混合气→c→d→e→e→a |
| C.混合气→a→e→e→b→d→c |
| D.混合气→b→e→a→d→c |
下列叙述正确的是( )
| A.SO2具有还原性,故可作漂白剂 |
| B.Na的金属活动性比Mg强,故可用Na与MgCl2溶液反应制Mg |
| C.浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色 |
| D.Fe在Cl2中燃烧生成FeCl3,故在与其他金属反应的产物中的Fe也显+3价 |
对金属锌与浓硫酸的反应来说,下列说法不当的是( )
| A.若金属锌足量,反应所放出的气体应为混合物 |
| B.反应消耗的锌的物质的量一定等于反应生成的气体的物质的量 |
| C.反应中所转移的电子的物质的量一定等于反应生成的气体的物质的量2倍 |
| D.由于金属铝的活动性强于锌,所以铝与浓硫酸的反应一定比锌与浓硫酸反应剧烈 |
某化学兴趣小组对广州亚运会金牌中金属的成分提出猜想:甲认为该金牌是由纯金制成;乙认为该金牌是由金银合金制成;丙认为该金牌是由黄铜(铜锌合金)制成.为了验证他们的猜想,取制造这种金牌的材质粉末少量进行实验,加入下面一种试剂来验证甲、乙、丙猜想的正误,该试剂应是( )
| A.硫酸铜溶液 | B.稀硝酸 |
| C.盐酸 | D.硝酸银溶液 |