下列实验现象预测正确的是(双选) ( )。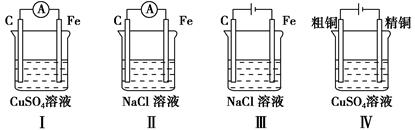
| A.实验Ⅰ:电流表A指针偏转,碳棒上有红色固体析出 |
| B.实验Ⅱ:电流表A指针偏转,铁极上有无色气体产生 |
| C.实验Ⅲ:碳棒上有无色气体产生,铁极上有黄绿色气体产生 |
| D.实验Ⅳ:粗铜溶解,精铜上有红色固体析出 |
根据碘与氢气反应的热化学方程式(i) I2(g)+H2(g) 2HI(g) △H=" -" 9.48kJ/mol (ii) I2(s)+H2(g)
2HI(g) △H=" -" 9.48kJ/mol (ii) I2(s)+H2(g) 2HI(g) △H="+" 26.48kJ/mol。下列判断正确的是
2HI(g) △H="+" 26.48kJ/mol。下列判断正确的是
| A.254g I2(g)中通入2g H2(g),反应放热9.48 kJ |
| B.1 mol固态碘与1mol气态碘所含的能量相差l7.00 kJ |
| C.反应(i)的产物比反应(ii)的产物稳定 |
| D.反应(i) 拆开1mol I-I键与1mol H-H键需要的总能量小于拆开2mol H-I键需要的总能量 |
在容积为2L的密闭容器中充入2molSO2和一定量O2,发生反应2SO2+O2 2SO3,当反应进行到4min时,测得n(SO2)=0.6mol。若反应进行到2min时,容器中SO2的物质的量是
2SO3,当反应进行到4min时,测得n(SO2)=0.6mol。若反应进行到2min时,容器中SO2的物质的量是
| A.等于1.3mol | B.小于1.3mol | C.大于1.4mol | D.等于1.4mol |
已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H1
2 H2(g)+ O2(g)= 2H2O(g) △H2
C(s)+ O2(g)=CO2(g) △H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
| A.12△H3+5△H2-2△H1 | B.2△H1-5△H2-12△H3 |
| C.12△H3-5△H2-2H1 | D.△H1-5△H2-12△H3 |
在气体参与的反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是
①增大反应物的浓度 ②升高温度 ③增大压强 ④移去生成物 ⑤加入催化剂
| A.①②③ | B.①②③⑤ | C.②⑤ | D.①②③④⑤ |
以下反应可以用熵判据来解释的是
| A.硫酸铜饱和溶液降低温度时有晶体析出 |
| B.(NH4)2CO3(s)==NH4HCO3(s)+NH3(g) △H=+74.9kJ/mol |
| C.CaO(s)+CO2(g)==CaCO3(s) △H="-175.7kJ/mol" |
| D.2H2(g)+O2(g) ==2H2O(l) △H=-285.8kJ/mol |