某课外小组对一些金属单质和化合物的性质进行探究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 |
实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
| 反应结束后分离出溶液备用 |
|
| 红色固体用蒸馏水洗涤后,置于潮湿空气中 |
一段时间后固体由红色变为绿色[设其主要成分为Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应______________________________________________________;
化合反应______________________________________________________。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可以观察到的现象是________________________。
解释此现象的离子方程式是______________________________________。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰。
①用铝与软锰矿炼锰的原理是(用化学方程式来表示)________________________。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是_____________________________________。
根据下列有机物转化流程回答: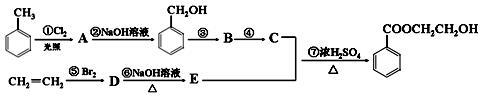
(1)写出A的结构简式:____________。
(2)属于取代反应的有(填序号):。属于加成反应的有(填序号):____________。
(3)写出第①步反应的化学方程式:___________________________
写出物质B与新制Cu(OH)2溶液反应的化学方程式:______________________
写出第⑥步反应的化学方程式:_______________________________
利用芳香烃X和链烃Y可以合成紫外线吸收剂BAD,已知G不能发生银镜反应,BAD结构简式为:
BAD的合成路线如下: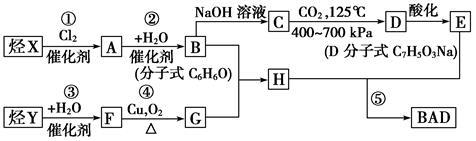
试完成下列问题:
(1)写出结构简式:Y________,D________。
(2)属于取代反应的有___________(填数字序号)。
(3)1 mol BAD最多可与含________mol NaOH的溶液完全反应。
(4)写出方程式:反应④___________________。
B+G―→H________________________。
葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
CH2OH(CHOH)4CHO+Br2+H2O → C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3 → Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见下表:
| 物质名称 |
葡萄糖酸钙 |
葡萄糖酸 |
溴化钙 |
氯化钙 |
| 水中的溶解性 |
可溶于冷水易溶于热水 |
可溶 |
易溶 |
易溶 |
| 乙醇中的溶解性 |
微溶 |
微溶 |
可溶 |
可溶 |
实验流程如下:
请回答下列问题:
(1)第 ① 步中溴水氧化葡萄糖时,下列装置最合适的是_________(填序号)。 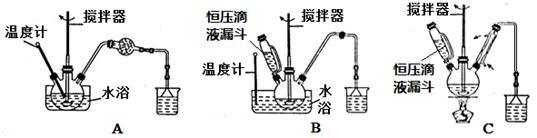
(2)第②步充分反应后CaCO3固体需有剩余,其目的是____________________。
(3)本实验中不宜用CaCl2替代CaCO3,理由是__________________________。
(4)第③步需趁热过滤,其原因是_______________________________。
(5)葡萄糖溶液与新制Cu(OH)2悬浊液反应的化学方程式为__________________。
芳香烃A的相对分子质量为118,以A为原料合成某香料中间体G的路线如下: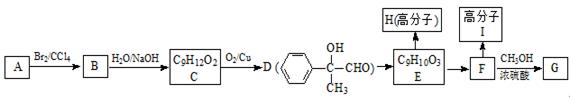
(1)A的分子式为 ,C中官能团的名称是 。
(2)E→F为消去反应,该反应的反应条件为 。I的结构简式为 。
(3)写出下列转化的化学方程式:
①E→H ;②F→G 。
(4)E有多种同分异构体,写出符合下列条件的同分异构体的结构简式: 。
①分子内含有苯环,核磁共振氢谱有4个吸收峰;
②既能与NaHCO3溶液反应产生气体,又能与FeCl3溶液发生显色反应。
松油醇是一种调香香精,它是α、β、γ三种同分异构体组成的混合物,可由松节油分馏产品A(下式中18是为区分两个羟基而人为加上去的)经下列反应制得: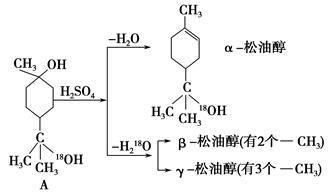
(1)A的分子式为__________________。
(2)γ松油醇的结构简式为_________________。
(3)α松油醇能发生的反应类型是________________(填代号)。
a.加成反应 b.水解反应 c.氧化反应 d.消去反应 e.取代反应
(4)在许多香料中松油醇还有少量以酯的形式出现,写出CH3COOH和α松油醇反应的化学方程式___________________________。