下列说法正确的是( )
| A.常温下将pH=2的醋酸和pH=12的NaOH溶液等体积混合,所得溶液显碱性 |
| B.已知同温时氢氟酸的电离常数大于亚硝酸的电离常数,则相同温度相同浓度的NaF溶液和NaNO2溶液的碱性:NaF溶液较强 |
| C.将等体积的盐酸和氨水混合,充分反应后所得溶液呈中性,则两溶液的物质的量浓度关系为:c(HCl)<c(NH3·H2O) |
| D.已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)= c(CO32-),且c(Mg2+)·c(CO32-)=6.82×10-6 |
现有常温下的四种溶液(如下表),下列有关叙述中正确的是
| ① |
② |
③ |
④ |
|
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
| pH |
11 |
11 |
3 |
3 |
A.V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=9:11
B.在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变
C.分别加水稀释10倍、四种溶液的pH:①>②>③>④
D.将①、④两种溶液等体积混合,所得溶液中:c (NH4+)>c(Cl-)>c(OH-)>c(H+)
已知25 ℃时,BaCO3的溶度积Ksp=2.58×10-9,BaSO4的溶度积Ksp=1.07×10-10,则下列说法不正确的是
| A.25 ℃时,当溶液中c(Ba2+)·c(SO42-)=1.07×10-10时,此溶液为BaSO4的饱和溶液 |
| B.25 ℃时,在含有BaCO3固体的饱和溶液中滴入少量Na2SO4溶液后有BaSO4沉淀析出,此时溶液中c(CO)∶c(SO)≈24.11 |
| C.因为Ksp(BaCO3)>Ksp(BaSO4),所以无法将BaSO4转化为BaCO3 |
| D.在饱和BaCO3溶液中加入少量Na2CO3固体,可使c(Ba2+)减小,BaCO3的溶度积不变 |
利用合成气(主要成分为 CO、CO2和 H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g)△H1=-99kJ·mol-1
CH3OH(g)△H1=-99kJ·mol-1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g) CO(g)+H2O(g)△H3=+41kJ·mol-1
CO(g)+H2O(g)△H3=+41kJ·mol-1
已知反应①中的相关的化学键键能数据如下,则 C-H 键能和△H2分别是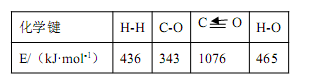
| A.403 kJ·mol-1,-66 kJ·mol-1 | B.423 kJ·mol-1,+28 kJ·mol-1 |
| C.413 kJ·mol-1,-58 kJ·mol-1 | D.314 kJ·mol-1,-18 kJ·mol-1 |
下列说法正确的是
| A.天然植物油常温下-般呈液态,难洛于水,有恒定的熔点、沸点 |
| B.麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖 |
| C.若两种二肽互为同分异构体,则二者的水解产物不一致 |
| D.乙醛、氯乙烯和乙二醇均可作为合成聚合物的单体 |
某有机物有如下性质:①能和银氨溶液共热得到银镜;②加入碳酸氢钠无变化;③与含酚酞的氢氧化钠溶液共热,发现红色褪去。则该有机物可能是
| A.乙酸 | B.乙醛 | C.甲酸乙酯 | D.乙醇 |