为了证明醋酸是弱电解质,甲、乙、丙、丁、戊、己、庚七人分别选用下列试剂进行实验:
0.10 mol/L醋酸溶液、0.10 mol/L醋酸钠溶液、pH=3的盐酸、pH=3的醋酸、醋酸钠晶体、氯化钠晶体、甲基橙、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.10 mol/L的醋酸溶液pH=4,则认定醋酸是弱电解质,你认为这一方法正确吗? 。(填“正确”或“不正确”)
(2)乙取出10 mL 0.10 mol/L的醋酸溶液,用pH试纸测出其pH=a,然后用蒸馏水稀释到1 000 mL,再用pH试纸测定其pH=b,要确定醋酸是弱电解质,则a、b应该满足的关系是 (用等式或不等式表示)。
(3)丙取出10 mL 0.10 mol/L醋酸溶液,滴入甲基橙试液,显红色,再加入醋酸钠晶体,颜色变橙色,你认为这一方法能否证明醋酸是弱电解质? 。(填“能”或“不能”)
(4)丁用pH试纸来测定0.10 mol/L醋酸钠溶液的pH,发现0.10 mol/L醋酸钠溶液的pH为9,则认定醋酸是弱电解质,你认为这一方法正确吗? 。(填“正确”或“不正确”)
用石墨作电极电解下列溶液①稀H2SO4②K2SO4溶液③CuCl2溶液④CuSO4溶液⑤KOH溶液
(1)阴极、阳极都有气体产生,且体积比(相同条件下)为2∶1的是(填序号),其阳极的电极反应式都是,阴极的电极反应式都是,总反应的化学方程式都是。
(2)阴极、阳极都有气体产生,其中溶液pH变小的是,pH变大的是。(填序号)
(3)一个电极析出金属,一个电极逸出气体,且溶液pH明显减小的是(填序号),其总反应的化学方程式是。
某学生设计了如图4-8所示的装置(框内部分未画出),在装置内起初发生的反应为Cu+H2SO4 H2↑+CuSO4,试回答:
H2↑+CuSO4,试回答:
(1)该装置的名称是(填“电解池”或“原电池”)。
(2)A、B中至少有一种是金属,接。
(3)C溶液中含有。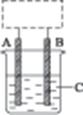
图4-8
按图4-7装置进行实验,并回答下列有关问题。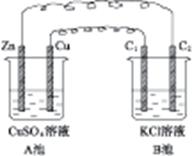
图4-7
(1)判断装置的名称:A池为,B池为。
(2)锌为极,电极反应式为。铜为极,电极反应式为。石墨棒C1为极,电极反应式为。石墨棒C2为极,电极反应式为。
(3)当C2极上析出224 mL气体(标准状况)时,锌的质量变化了(“增加”或“减少”)g,CuSO4溶液的质量变化了(“增加”或“减少”)g。
工业上为了处理含有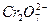 的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于排放标准。请回答下列问题:
的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于排放标准。请回答下列问题:
(1)两极发生的电极反应式为:阴极:______________;阳极:__________________。
(2)写出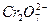 变为Cr3+的离子方程式:__________________________。
变为Cr3+的离子方程式:__________________________。
(3)工业废水由酸性变为碱性的原因是:___________________________。
(4)_________(填“能”或“不能”)改用石墨电极,原因是______________________。
在常温、常压下,用铂作电极电解CuSO4溶液。通电一段时间,切断电源,一个电极的质量增加了0.127 g,另一电极的气体产物的质量应是__________g,溶液的pH________(填“增大”“减少”或“不变”)。