研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)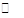 NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
2NO(g)+Cl2(g)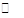 2ClNO(g) K2 ∆H < 0 (II)
2ClNO(g) K2 ∆H < 0 (II)
(1)4NO2(g)+2NaCl(s)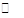 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后
n(Cl2)= mol,NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”。若要使K2减小,可采用的措施是 。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol•L‾1的CH3COONa溶液,则两溶液中c(NO3‾)、c(NO2-)和c(CH3COO‾)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10-4mol•L‾1,CH3COOH的电离常数K a=1.7×10-5mol•L‾1,可使溶液A和溶液B的pH相等的方法是 。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
2008年是中国改革开放30周年。30年来,中国发生了天翻地覆的变化,根据相关资料完成下列问题。
材料一:实现和平发展,是中国人民的真诚愿望和不懈追求。自20世纪70年代末实行改革开放以来,中国成功地走上了一条与本国国情和时代特征相适应的和平发展道路。通过这条道路,中国人民正努力把自己的国家建设成为富强、民主、文明、和谐的现代化国家,并以自身的发展不断对人类进步事业作出新的更大的贡献。中国坚持走和平发展道路,积极发展对外关系,加强同世界各国的合作,坚决反对霸权主义和强权政治,永远不称霸。
材料二:省长姜大明同志在山东省对外开放会议上要求,要全力提升对外开放水平,以改革开放30周年为新的起点,为夺取全面建设小康社会新胜利、在新起点上实现富民强省新跨越作出新的更大贡献。
(1)结合所学政治生活知识说明我国为什么坚持走和平发展道路。
(2)某中学高三某班同学展开研究性学习,准备召开主题班会,为全力提升山东省对外开放水平给省政府献计献策。请结合经济生活的有关知识,写出你的发言提纲。
长期以来,我们在周边坚持大小国家平等相待,坚持和平解决争端,坚持不干涉别国内政。我们与东盟建设自由贸易区,促进互利共荣的经济融合,谋求共同发展与繁荣。我们推进上海合作组织,倡导树立以互信、互利、平等、协作为核心的新安全观。我们尊重周边国家的不同文化、宗教和历史背景,推动多种文明和平共处。同时,重点加强了与周边国家的环境合作。我们将本着积极稳妥的精神,与周边国家一道,继续沿着这个方向作出努力。
该材料是如何具体体现我国主张的国际新秩序的内容的?
当前,国际形势总体上保持稳定,同时,全球经济失衡加剧,国际安全形势更加复杂,人类面临诸多难题和挑战。共同分享发展机遇,共同应对各种挑战,推进人类和平与发展的崇高事业,是各国人民的共同愿望。中国将高举和平、发展、合作旗帜,始终不渝走和平发展道路,始终不渝实施互利共赢的开放战略,继续致力于推进国际关系民主化,推动经济全球化朝着均衡、普惠、共赢方向发展,促进人类文明交流互鉴,呵护人类赖以生存的地球家园,维护世界和平稳定。
回答下列问题:
(1)和平、发展、合作的旗帜体现了我国外交政策的哪些基本点?
(2)分析说明中国政府和人民和平、发展、合作旗帜的政治学依据。
四川汶川发生8.0级地震后,某校高三(2)班的同学以“万众一心,抗震救灾”为主题进行了探究,下面是他们搜集的资料和问题,请你参加研究解答。
地震发生后,在党中央、国务院和中央军委的坚强领导下,全党全军全国各族人民万众一心、众志成城,展开了气壮山河的抗震救灾斗争。经过艰苦卓绝的努力,目前抗震救灾斗争取得了重大阶段性胜利!
地震发生后,党中央心系灾区人民安危,坚持以人为本,果断决策,紧急部署。胡锦涛总书记在灾情发生后立刻发出重要指示。以后又多次召开中央政治局会议研究部署抗震救灾工作。有评论说这次抗震救灾可以看作是党中央号召加强党的执政能力建设几年来的一次大练兵。从决策到组织、协调,从应急管理到建立长效机制,从短期救治到长期的规划重建,无一不是艰巨考验。各级党委和广大党员、干部在各个岗位上交出了一份令人满意的答案。
当大地震袭来之时,位于嘉陵江畔的徐家坪村房屋倒塌,瞬息之间变成一片废墟。全村149户578人中,80户226人受灾,17户54人无家可归。望着无助的村民们,村支书蹇军高声喊道:“大家不要急,不要慌,党员和年轻人跟我来。如果大家没有吃的,就到我家里去吃;如果大家没有住处,就住在我家里。”
抗震救灾要举全国之力,建立和完善对口支援机制是举全国之力的一项有效措施。江苏对口支援的是地震重灾区德阳,省委、省政府高度重视支援灾区的重建工作。
(1)假如你是一名入党积极分子,结合蹇军的言行,你准备如何践行党的宗旨?
(2)假如你要对江苏省政府支援灾区重建工作提出合理化建议,应该通过哪些具体途径?
四川汶川发生8.0级地震后,在党中央、国务院和中央军委的坚强领导下,全党全军全国各族人民万众一心、众志成城,展开了气壮山河的抗震救灾斗争。经过艰苦卓绝的努力,目前抗震救灾斗争取得了重大阶段性胜利!
地震发生后,党中央心系灾区人民安危,坚持以人为本,果断决策,紧急部署。胡锦涛总书记在灾情发生后立刻发出重要指示。以后又多次召开中央政治局会议研究部署抗震救灾工作。有评论说这次抗震救灾可以看作是党中央号召加强党的执政能力建设几年来的一次大练兵。从决策到组织、协调,从应急管理到建立长效机制,从短期救治到长期的规划重建,无一不是艰巨考验。各级党委和广大党员、干部在各个岗位上交出了一份令人满意的答案。
当大地震袭来之时,位于嘉陵江畔的徐家坪村房屋倒塌,瞬息之间变成一片废墟。全村149户578人中,80户226人受灾,17户54人无家可归。望着无助的村民们,村支书蹇军高声喊道:“大家不要急,不要慌,党员和年轻人跟我来。如果大家没有吃的,就到我家里去吃;如果大家没有住处,就住在我家里。”
抗震救灾要举全国之力,建立和完善对口支援机制是举全国之力的一项有效措施。江苏对口支援的是地震重灾区德阳,省委、省政府高度重视支援灾区的重建工作。
(1)有人认为,坚持中国共产党的领导是取得抗震救灾胜利的唯一保证。请谈谈你的认识。
(2)结合材料谈谈你对“中国共产党不仅有历史和法律赋予的执政资格,也具有与时俱进的执政能力”这一观点的理解。