(1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为 ,请预测B的核磁共振氢谱上有 个峰(信号)。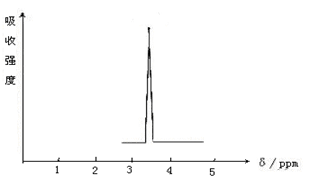
(2)用系统命名法命名下列物质
①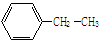
②CH3CH2CH=CHCH3
(3)写出结构简式或名称:
①分子式为C8H10的芳香烃,苯环上的一溴取代物只有一种,写出该芳香烃结构简式________
②戊烷(C5H12)的某种同分异构体只有一种一氯代物,写出该戊烷的名称_____
合成氨反应是化学上最重要的反应:
(1)合成氨原料气中的氢气可利用天然气(主要成分为CH4)在高温、催化剂作用下与水蒸气反应制得,反应中每生成2 mol CO2吸收316kJ热量,该反应的热化学方程式是_______________________,该方法制得的原料气中主要杂质是CO2,若用K2CO3溶液吸收,该反应的离子方程式是________________。
(2)已知N2(g)+3H2(g)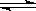 2NH3(g) ΔH<0。下图是当反应器中按n(N2)∶n(H2)=1∶3投料后,在200 ℃、400 ℃、600 ℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
2NH3(g) ΔH<0。下图是当反应器中按n(N2)∶n(H2)=1∶3投料后,在200 ℃、400 ℃、600 ℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。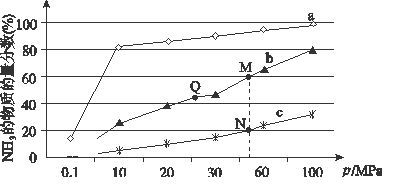
①曲线a对应的温度是________。
②关于工业合成氨的反应,下列叙述正确的是________(填序号)
| A.上图中M、N、Q点平衡常数K的大小关系为K(M)=K(Q) >K(N) |
| B.加催化剂能加快反应速率但H2的平衡转化率不变 |
| C.相同压强下,投料相同,达到平衡消耗时间关系为c>b>a |
| D.由曲线a可知,当压强增加到100 MPa以上,NH3的物质的量分数可达到100% |
③N点时c(NH3)=0.2 mol·L-1,N点的化学平衡常数K=_________________(精确到小数点后两位)。
(3)合成氨工业中含氨废水的处理方法之一是电化学氧化法,将含氨的碱性废水通入电解系统后,在阳极上氨被氧化成氮气而脱除,阳极的电极反应式为______________________。
(4)NH3可以处理NO2的污染,方程式如下: NO2+ NH3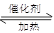 N2+ H2O(未配平)当转移0.6 mol电子时,消耗的NO2在标准状况下是 L。
N2+ H2O(未配平)当转移0.6 mol电子时,消耗的NO2在标准状况下是 L。
2015年8月12日晚,天津滨海新区某公司仓库发生爆炸,事发仓库里存放了大量的硝酸铵、氰化钠(NaCN)、金属钠等危险化学品。回答下列问题:
(1)NaCN的电子式为: 。
(2)金属钠属于危化品中的易燃固体,其着火时不能用水灭火,请用化学方程式解释其原因:_____________________________。
(3)氰化钠是一种重要的化工原料,也是剧毒危险品,皮肤伤口接触、吸入、吞食微量可中毒死亡。氰化钠易溶于水,水溶液呈强碱性。氰化钠泄露可用双氧水或硫代硫酸钠中和。
①用离子方程式表示氰化钠水溶液呈强碱性的原因: 。
②用双氧水处理产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,请写出该反应的化学方程式_____________________________;
③用硫代硫酸钠中和的离子方程式为CN—+S2O32—→A+SO32—(已配平),A为 (填化学式)。
(4)CN— 中C元素显+2价,N元素显﹣3价,则非金属性N_______C(填<、=或>),请用简单的实验方法证明(要求说明简单操作、现象和结论): 。
(5)0.4mol/L 的NaCN和0.2mol/L的HCl等体积混合,溶液显碱性,其溶液中离子浓度大小排列顺序是
在一定温度下,10L恒容密闭容器中加入0.05molSO2、0.03molO2,反应为:
2SO2(g)+O2(g)=2SO3(g) ΔH<0,经10min后反应达到平衡,测得C(SO3)=0.004mol/L
(1) SO2的转化率为 ,若在原平衡的基础上再加入0.05molSO2、0.03molO2达到平衡时,SO2的转化率将 (填增大、减小或不变)
(2) 用SO2表示该反应的反应速率为
(3) 平衡时容器内气体压强与反应前的压强之比 (最简整数比)
(4) 平衡时体系中SO3的百分含量(体积分数)
(5) 平衡常数K= ;升高温度K将 (填增大、减小或不变);假如某时刻时SO2为0.02mol,该反应向 (填正向、逆向或不)移动。
在密闭容器中的可逆反应2CO(g)+2NO(g) 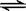 2CO2(g)+N2(g) ΔH<0达到平衡后:
2CO2(g)+N2(g) ΔH<0达到平衡后:
(1)扩大容器体积,平衡 (填正向、逆向或不)移动,C(NO)将 (填增大、减小或不
变),反应混合物的总物质的量 (填增大、减小或不变)。
(2)升高温度平衡 (填正向、逆向或不)移动,该反应体系的压强(填增大、减小或
不变),该反应的逆反应速率 (填增大、减小或不变)。
(3)加入催化剂,NO的物质的量 (填增大、减小或不变)理由是 。
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气, 放出256.64kJ的热量。
(1)写出该反应的热化学方程式
(2)已知H2O(l)=H2O(g)△H=+44kJ·mol-1,则16g液态肼燃烧生成氮气和液态水时,放出的量是 kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的 优点
(4)已知N2(g)+2O2(g)="2" NO2(g) △H=" +68" kJ·mol-1, N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式