合成氨是人类研究的重要课题,目前工业合成氨的原理为:
N2(g)+3H2(g)  2NH3(g) ΔH=-93.0kJ/mol
2NH3(g) ΔH=-93.0kJ/mol
某温度下,在2 L密闭容器中发生上述反应,测得数据如下
| 时间/h 物质的量/mol |
0 |
1 |
2 |
3 |
4 |
| N2 |
2.0 |
1.83 |
1.7 |
1.6 |
1.6 |
| H2 |
6.0 |
5.49 |
5.1 |
4.8 |
4.8 |
| NH3 |
0 |
0.34 |
0.6 |
0.8 |
0.8 |
①0~2 h内,v(N2)= 。
②平衡时,H2的转化率为_________________
③若保持温度和体积不变,起始投入的N2、H2、NH3的物质的量分别为a mol、b mol、c mol,达到平衡后,NH3比的浓度与上表中相同的为 (填选项字母)。
A.a=l、b=3.c=0 B.a=4、b=12、c=0
C.a=0、b=0.c=4 D.a=l、b=3、c=2
检验试管中盛有的少量白色固体是铵盐的方法是
| A.将固体加热,用湿润的红色石蕊试纸在试管口检验,看是否变蓝 |
| B.加水溶解,用pH试纸测溶液的酸碱性 |
| C.加入NaOH溶液,加热,再滴入酚酞试液 |
| D.加入NaOH溶液,加热,用湿润的红色石蕊试纸在试管口检验,看是否变蓝 |
下列电子式正确的是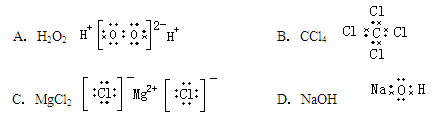
下列有关酸雨的说法正确的是
| A.酸雨就是指pH<7的雨水 |
| B.酸雨是因为雨水中含有CO2 |
| C.工业上大量燃烧含硫燃料和以含硫矿石为原料冶炼金属产生的SO2是产生硫酸型酸雨的主要原因 |
| D.酸雨没有危害,所以不必担心,也不必想办法治理 |
(1)钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH,其电极反应为:Zn + 2OH--2e- =" ZnO" + H2O Ag2O + H2O + 2e- =" 2Ag" + 2OH-
电池的负极是 (填电极材料),正极发生的是 反应(填反应类型),
总反应式为 。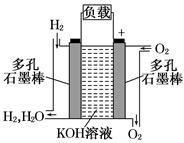
(2)图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从两极通入燃料电池时,便可在闭合回路中不断地产生电流.这被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。试回答下列问题:
①图中通过负载的电子流动方向______ (填“向左”或“向右”).
②写出氢氧燃料电池工作时正极反应方程式 :
③放电过程中,负极附近溶液的pH (填“增大”,“减小”,“保持不变”)
A、B、C、D、E五种短周期元素的原子序数依次增大,上述元素中只有一种金属元素。A、B同周期,化合物AB2、DB2均是可使澄清石灰水变浑浊的气体。又已知C、E的单质均可溶于NaOH溶液,且C与NaOH溶液反应可产生气体。
(1)写出E元素的名称: E________
(2)画出C原子的原子结构示意图,写出AB2的结构式
(3)写出DB2使澄清石灰水变浑浊的化学方程式:_____________________
(4)写出E的单质与NaOH溶液反应的离子方程式:________________________________________