二氧化硅(SiO2)又称硅石,是制备硅及其化合物的重要原料(如图)。下列说法
正确的是( )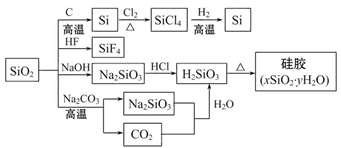
| A.SiO2属于两性氧化物 |
| B.盛放Na2CO3溶液的试剂瓶不能用玻璃塞 |
| C.硅胶吸水后不能重复再利用 |
| D.图中所示的转化反应都是氧化还原反应 |
重水(2H2O)是重要的核工业原料,下列说法不正确的是
A.HClO的电子式: 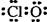 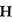 |
| B.11H与21H是不同的核素 |
| C.1H2O与2H2O是同一种物质 |
D.离子结构示意图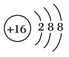 可以表示32S2—,又可以表示34S2— 可以表示32S2—,又可以表示34S2— |
化学与科技、环境、社会生产、生活密切相关,下列有关说法不正确的是
| A.绿色化学的核心是利用化学原理治理环境污染 |
| B.硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料 |
| C.大量使用风能、太阳能、生物质能,符合“低碳”理念 |
| D.蒙古牧民喜欢用银器盛放鲜牛奶有其科学道理:用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的细菌,防止牛奶变质 |
一块已被部分氧化为Na2O的钠块10.8g,将其投入一定量水中,最终得到1L 0.4mol·L-1的NaOH溶液,则原固体中氧化钠的质量是
| A.8.5g | B.10.8g | C.6.2g | D.4.6g |
下列离子方程式正确的是
| A.稀硫酸滴在铜片上Cu + 2H+ = Cu2+ + H2↑ |
| B.氧化铜与硫酸混合Cu2+ + SO42—= CuSO4 |
| C.硝酸滴在石灰石上CO32- + 2H+ = Ca2+ + H2O+CO2↑ |
| D.硫酸钠溶液与氯化钡溶液混合Ba2+ + SO42— =BaSO4↓ |
下列各组物质相互混合后,不会发生离子反应的是
| A.Na2SO4溶液和KCl溶液 | B.Na2CO3溶液和稀硫酸 |
| C.NaOH溶液和Fe2(SO4)3溶液 | D.Ca(OH)2和盐酸 |