短周期金属元素甲~戊在元素周期表中的相对位置如图所示。下列判断正确的是( )。
| 甲 |
乙 |
|
| 丙 |
丁 |
戊 |
A.原子半径:丙<丁<戊 B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊 D.最外层电子数:甲>乙
将质量相等的A、B、C三种金属,同时分别放入三份溶质质量分数相同且足量的稀盐酸中,反应生成H2的质量与反应时间的关系如图所示。根据图中所提供的信息,得出的结论正确的是(已知:A、B、C在生成物中均为+2价):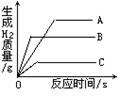
A.放出H2的质量是C>B>A
B.金属活动性顺序是A>B>C
C.反应速率最大的是A
D.相对原子质量是C>B>A
物质的颗粒达到纳米级时,具有特殊的性质。如将单质铜制成“纳米铜”时,“纳米铜”具有非常强的化学活性,在空气中可以燃烧。下列叙述中正确的是
| A.常温下,“纳米铜”与铜片的还原性相同 |
| B.常温下,“纳米铜”比铜片更易失电子 |
| C.常温下,“纳米铜”比铜片的金属性强 |
| D.常温下,“纳米铜”比铜片的氧化性强 |
向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol·L-1的稀硝酸,恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
A.0.24 mol mol |
B.0.21 mol | C.0.16 mol | D.0.14 mol |
把SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,这时候若滴入BaCl2溶液,会产生白色沉淀,在上述一系列变化过程中,最终被还原的是
| A.SO2 | B.Cl- | C.Fe3+ | D.NO3- |
某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是
| A.该溶液可能是由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成 |
| B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 |
| C.加入适量NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| D.加入适量氨水,c(CH3COO— ) 一定大于c(Na+ )、c(NH4+)之和 |