对已经达到化学平衡的下列反应: 2X(g)+Y(g)  2Z(g),减小压强时 ( )
2Z(g),减小压强时 ( )
| A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 |
| B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动 |
| C.正、逆反应速率都减小,平衡向逆反应方向移动 |
| D.正、逆反应速率都增大,平衡向正反应方向移动 |
向三份0.1mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2CO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为()
| A.减小、增大、减小 |
| B.增大、减小、减小 |
| C.减小、增大、增大 |
| D.增大、减小、增大 |
已知某溶液中存在 四种离子,其浓度大小有如下关系
四种离子,其浓度大小有如下关系
①
②
③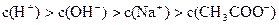
④
其中正确的是()
| A.①②③ | B.①②④ | C.①③④ | D.②③④ |
下列离子方程式书写正确的是()
A.用石墨为电极电解硫酸铜溶液:Cu  Cu+4H Cu+4H |
B.泡沫灭火器工作时化学反应: |
C.硫酸镁溶液与氢氧化钡溶液反应: |
| D.过量碳酸氢钠溶液与氢氧化钡溶液反应: |

为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性
②取少量溶液中入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体
③在上述溶液中再滴加Ba(NO3)3溶液,产生白色沉淀
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀
根据实验以下推测正确的是()
A.一定有 离子 离子 |
B.一定有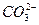 离子 离子 |
| C.Cl-离子一定存在 | D.不能确定HCO 离子是否存在 离子是否存在 |
25°C时,几种弱酸的电离常数如下
| 弱酸化学式 |
CH3COOH |
HCN |
H2S |
| 电离常数(25°C) |
1.8 |
 |
 |
25°时,下列说法正确的是()
A.等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN)
B.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.某浓度HCN的水溶液pH=d,则其中c(OH-)=10-dmol/L
D.NaHS和Na2S混合溶液中,一定存在c(Na+)+c(H+)===c(OH-)+c(HS-)+2c
(S2-)