相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
实验测得起始、平衡时的有关数据如下表:
| 容器 编号 |
起始时各物质物质的量/mol |
平衡时反应中的能量变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出热量a kJ |
| ② |
2 |
3 |
0 |
放出热量b kJ |
| ③ |
2 |
6 |
0 |
放出热量c kJ |
下列叙述正确的是 ( )。
A.放出热量关系:a<b<92.4
B.三个容器内反应的平衡常数:③>①>②
C.达平衡时氨气的体积分数:①>③
D.N2的转化率:②>①>③
下列离子检验的结论可靠的是
| A.用干燥洁净的铂丝蘸取溶液,在火焰上灼烧,若火焰里黄色,证明不含K+ |
| B.向溶液中加入新制氯水和CCl4,振荡、静置,若上层溶液呈紫红色,证明含有I- |
| C.向溶液中先加入新制氯水,再加入KSCN溶液,若溶液呈血红色,证明含有Fe2+ |
| D.向溶液中加入氢氧化钠溶液,若立即产生红褐色沉淀,证明含有Fe3+ |
X、Y、Z、W四种短周期元素在周期表中相对位置如表所示,Y、Z质子数之和为21,下列说法中不正确的是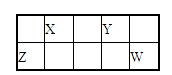
| A.X、Y、Z、W均为非金属元素 |
| B.Y、Z形成的化合物为离子晶体 |
| C.Z的阳离子与Y的阴离子电子层结构相同 |
| D.X、Y、W的氢化物中,Y的氢化物沸点最高 |
在碱性条件下能够大量共存,而在强酸性条件下却能发生氧化还原反应的离子组是
| A.Ca2+、AlO2-、SO42-、Cl- | B.K+、Na+、ClO-、Cl- |
C.Na+、Fe2+、NO 3-、SO42- 3-、SO42- |
D.NH4+、Na+、F-、CO32- |
NA表示阿伏加德 罗常数的值,下列说法正确的是
罗常数的值,下列说法正确的是
| A.5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA |
| B.12.5mL 16mol·L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
| C.7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
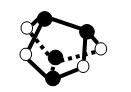
| D.0.5mol雄黄(As4S4,结构如右图)含有NA个S—S键 |
设NA表示阿伏加德罗常数,下列叙述中正确的是
| A.常温常压下,11.2 LCO2所含的原子数为1.5NA |
| B.常温常压下,48 g O3含有的氧原子数为3NA |
| C.标准状况下,22.4 L H2O所含分子数为NA |
| D.标准状况下,22.4 L H2中所含原子数为2NA |