为了提高资源利用率,减少环境污染,化工集团将钛厂、氯碱厂和甲醇厂组成产业链,如图所示。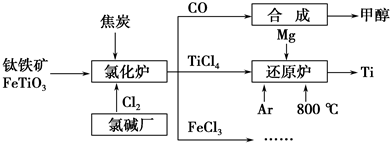
请填写下列空白:
(1)钛铁矿进入氯化炉前通常采取洗涤、粉碎、烘干、预热等物理方法处理,请从原理上解释粉碎的作用:_______________________________________;
已知氯化炉中反应氯气和焦炭的理论用料物质的量比为7∶6,则氯化炉中的还原剂化学式是_________________________________________________。
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s) ΔH=-641 kJ·mol-1
②2Mg(s)+TiCl4(s)=2MgCl2(s)+Ti(s) ΔH=-512 kJ·mol-1
则Ti(s)+2Cl2(g)=TiCl4(s) ΔH=________。
(3)Ar气通入还原炉中并不参与反应,通入Ar气的作用是_________________________________________________________________。
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为2CH3OH+3O2+4OH-===2CO32—+6H2O,该电池中正极上的电极反应式为____________________________________________。
工作一段时间后,测得溶液的pH________(填“减小”、“增大”或“不变”)。
油脂A经下列途径可得到治疗心血管疾病药物M(分子式:C3H5O9N3)。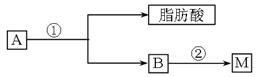
图中②提示:
C2H5OH+HO-NO2  C2H5O-NO2+H2O
C2H5O-NO2+H2O
硝酸硝酸乙酯
(1)指出反应①的反应类型:_______________________。
(2)反应②的化学方程式是______________________________________________。
(3)药物M在人体内能释放出一种“信使分子”C,C是双原子分子,遇空气后转化为红棕色气体,则C的 分子式为________________。
分子式为________________。
(4)D是B和乙酸在一定条件下反应生成的化合物,相对分子质量为134,写出D所有可 能的结构简式:________________________________________________。
能的结构简式:________________________________________________。
化合物A(C4H10O)是一种有机溶剂。A可以发生以下变化: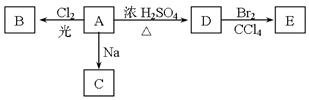
(1)A、D分子中的官能团名称分别是______________、_______________。
(2)A只有一种一氯取代物B。写出由A转化为B的化学方程式:。
(3) A的同分异构体F也可以有框图 内A的各种变化,且F烃基上的一氯取代物有三种。F的结构简式是___________________________________________。
内A的各种变化,且F烃基上的一氯取代物有三种。F的结构简式是___________________________________________。
(4)A与化合物“HQ”在一定条件下相互作用形成水与一种食品抗氧化剂“TBHQ”。已知“HQ”(C6H6O2)可以与三氯化铁溶液发生显色反应,且“HQ”的一硝基取代物只有一种,则“HQ”的结构简式为___________________________。
烃A的分子式为C3H8,B、C是A的一氯代物,A~I有如下转化关系:
回答下列问题:
(1)C的结构简式_____________________。
(2)指出下列反应类型:
A→B:_____________________反应;E→D:______________________反应。
(3)写出下列转化的化学方程式:
B→D:_______________________________________________________________;
E+H→I:_____________________________________________________________。
(4)H有多种同分异构体。写出满足①分子结构中有羟基:②与新制Cu(OH)2共热生成红色沉淀两个条件的一种同分异构体的结构简式:
_________________________________________________________________(只写一种)。
在有机物分子中碳原子所连的4个原子或原子团均不相同时,该碳原子叫手性碳原子,以*C表示。而且,该有机化合物具有光学活性。下列有机物
是否具有光学活性?(填有或无)若有请在上面的结构简式中用*表示出手性碳原子。若消除其光学活性,可选用的化学反应有哪些?请写出化学反应方程式。
1
2
3
4
(本题共6分,每空1分)请同学们根据官能团的不同对下列有机物进行分类。
(1)芳香烃:;(2)卤代烃:;
(3)醇:;(4)酚:;
(5)醛:;(6)酯:。