短周期元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数之和为14。X与Z同主族,Y与W同主族,且X的原子半径小于Y。下列叙述正确的是( )。
| A.Y的简单阴离子半径小于Z的简单阳离子半径 |
| B.Y与X形成的化合物沸点高于W与X形成的化合物的沸点 |
| C.X2Y2加入酸性高锰酸钾溶液中,X2Y2作氧化剂 |
| D.W元素的最高价氧化物对应的水化物是弱酸 |
已知图一表示的是可逆反应CO(g)+H2(g) C(s)+H2O(g)△H>0的化学反应速率与实践的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g)△H>0的化学反应速率与实践的关系,图二表示的是可逆反应2NO2(g) N2O4(g) △H<0的浓度随时间的变化情况。下列说法中正确的是( )
N2O4(g) △H<0的浓度随时间的变化情况。下列说法中正确的是( )
| A.图一t2时改变的条件可能是升高了温度或增大了压强 |
| B.图一t2时改变的条件一定是增大了反应物的浓度 |
| C.图二t1时改变的条件可能是升高了温度或增大了压强 |
| D.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小 |
99℃时,Kw=1.0×10-12,该温度下测得0.1mol/LNa2A溶液的pH=6。下列说法不正确的是( )
| A.H2A在水溶液中的电离方程式为H2A=2H++A2- |
| B.该温度下,将0.01mol/L的H2A溶液稀释20倍后溶液的pH=3 |
| C.体积相同,pH均为1的盐酸和H2A溶液分别与足量的Zn反应,产生H2较多的是H2A |
| D.将0.1mol/L的H2A溶液与0.2mol/L的氨水等体积混合后,溶液中浓度最大的离子是NH4+ |
对于化学反应方向的确定不仅与焓变(△H)有关,也与温度(T)、熵变(△S)有关,实验证明,化学反应的方向应由△H-T△S确定,若△H-T△S<0则自发进行,否则不能自发进行,下列说法中,正确的是()
| A.在温度、压力一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 |
| B.温度、压力一定时,放热的熵增加反应不一定能自发进行 |
| C.反应焓变是决定反应能否自发进行的唯一因素 |
| D.固体的溶解过程只与焓变有关 |
在某恒容密闭容器中进行如下可逆反应:2M(g)+N(g) W(?)+4Q(g)△H<0,起始投料只有M和N。下列示意图正确且能表示该可逆反应达到平衡状态的是
W(?)+4Q(g)△H<0,起始投料只有M和N。下列示意图正确且能表示该可逆反应达到平衡状态的是
A. |
B.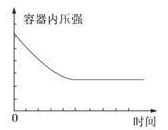 |
C.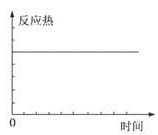 |
D. |
某小组为研究金属的腐蚀与防护,设计如图所示装置。下列叙述不正确的是( )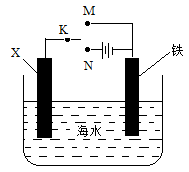
| A.若X为碳棒,为减缓铁的腐蚀,开关K应置于N处 |
| B.若X为碳棒,开关K置于M处,会加快铁的腐蚀 |
| C.若X为锌,开关K置于M处,就是牺牲阳极的阴极保护法 |
| D.若X为锌,开关K置于N处,铁电极发生的反应为Fe-2e-=Fe3+ |