将煤转化为水煤气的主要化学反应为C(s)+H2O(g) CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
H2(g)+ O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:_______________________________。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出如图循环图
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。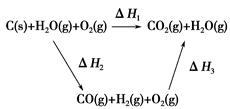
请分析:甲、乙两同学观点正确的是________(填“甲”或“乙”);判断的理由是________________________________________________________。
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点___________________________________________________。
(15分)化合物F是一种抗心肌缺血药物的中间体,可以通过以下方法合成:
(1)化合物A中的含氧官能团为_________和___________(填官能团的名称)。
(2)化合物B的结构简式为________;由C→D的反应类型是:_______。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式_________。
Ⅰ.分子含有2个苯环
Ⅱ.分子中含有3种不同化学环境的氢
(4)已知: ,请写出以
,请写出以 为原料制备化合物X(结构简式如下图)的合成路线流程图(无机试剂可任选)。
为原料制备化合物X(结构简式如下图)的合成路线流程图(无机试剂可任选)。
合成路线流程图示例如下: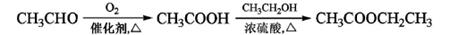
以磷石膏(只要成分CaSO4,杂质SiO2、Al2O3等)为原料可制备轻质CaCO3。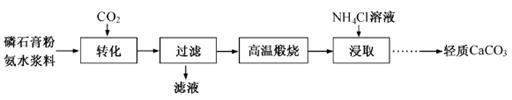
(1)匀速向浆料中通入CO2,浆料清液的pH和c(SO42-)随时间变化见由下图。清液pH>11时CaSO4转化的离子方程式_____________;能提高其转化速率的措施有____(填序号)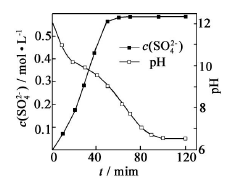
| A.搅拌浆料 | B.加热浆料至100℃ |
| C.增大氨水浓度 | D.减小CO2通入速率 |
(2)当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为______和________(填化学式);检验洗涤是否完全的方法是_________。
(3)在敞口容器中,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因___________。
[选修2—化学与技术]
20—Ⅰ下列有关海水综合利用的说法正确的是 。
| A.电解饱和食盐水可制得金属钠 | B.海带提碘只涉及物理变化 |
| C.海水提溴涉及到氧化还原反应 | D.海水提镁涉及到复分解反应 |
20—Ⅱ
铁在自然界分别广泛,在工业、农业和国防科技中有重要应用。
回答下列问题:
(1)用铁矿石(赤铁矿)冶炼生铁的高炉如图(a)所示。原料中除铁矿石和焦炭外含有 。除去铁矿石中脉石(主要成分为SiO2)的化学反应方程式为 、 ;高炉排出气体的主要成分有N2、CO2和 (填化学式)。
(2)已知:①Fe2O3 (s)+3C(s)=2Fe(s)+3CO(g) ΔH=+494kJ·mol-1
②CO(g)+ O2(g)=CO2(g) ΔH=-283kJ·mol-1
O2(g)=CO2(g) ΔH=-283kJ·mol-1
③C(s)+  O2(g)=CO(g)ΔH=-110kJ·mol-1
O2(g)=CO(g)ΔH=-110kJ·mol-1
则反应Fe2O3 (s)+3 C(s)+  O2(g)=2Fe(s)+3CO2 (g)的ΔH= kJ·mol-1。理论上反应 放出的热量足以供给反应 所需的热量(填上述方程式序号)
O2(g)=2Fe(s)+3CO2 (g)的ΔH= kJ·mol-1。理论上反应 放出的热量足以供给反应 所需的热量(填上述方程式序号)
(3)有人设计出“二步熔融还原法”炼铁工艺,其流程如图(b)所示,其中,还原竖炉相当于高炉的 部分,主要反应的化学方程式为 ;熔融造气炉相当于高炉的 部分。
(4)铁矿石中常含有硫,使高炉气中混有SO2污染空气,脱SO2的方法是 。
[选修3—物质结构与性质]
19—Ⅰ下列物质的结构或性质与氢键无关的是 。
| A.乙醚的沸点 | B.乙醇在水中的溶解度 |
| C.氢化镁的晶格能 | D.DNA的双螺旋结构 |
19—Ⅱ钒(23V)是我国的丰产元素,广泛用于催化及钢铁工业。
回答下列问题:
(1)钒在元素周期表中的位置为 ,其价层电子排布图为 。
(2) 钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为 、 。
(3)V2O5常用作SO2转化为SO3的催化剂。SO2分子中S原子价层电子对数是 对,分子的立体构型为 ;SO3气态为单分子,该分子中S原子的杂化轨道类型为 ;SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为 ;该结构中S—O键长由两类,一类键长约140pm,另一类键长约为160pm,较短的键为 (填图2中字母),该分子中含有 个σ键。
(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为 ;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为 。
[选修5—有机化学基础]18—Ⅰ下列有机物的命名错误的是
18—Ⅱ芳香族化合物A可进行如下转化:
回答下列问题:
(1)B的化学名称为 。
(2)由C合成涤纶的化学方程式为 。
(3)E的苯环上一氯代物仅有两种,E的结构简式为 。
(4)写出A所有可能的结构简式 。
(5)写出符合下列条件的E的同分异构体的结构简式 。
①核磁共振氢谱显示苯环上仅有两种氢
②可发生银镜反应和水解反应