2012年11月16日,5名男孩被发现死于贵州省毕节市七星关区街头垃圾箱内,经当地公安部门初步调查,5名男孩是因在垃圾箱内生火取暖导致CO中毒而死亡。
(1)CO中毒是由于CO与血液中血红蛋白的血红素部分反应生成碳氧血红蛋白,反应的化学方程式可表示为CO+HbO2 O2+HbCO,实验表明,c(HbCO)即使只有c(HbO2)的
O2+HbCO,实验表明,c(HbCO)即使只有c(HbO2)的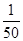 ,也可造成人的智力损伤。已知t ℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2 mol·L-1,若使c(HbCO)小于c(HbO2)的
,也可造成人的智力损伤。已知t ℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2 mol·L-1,若使c(HbCO)小于c(HbO2)的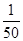 ,则吸入肺部CO的浓度不能超过________mol·L-1。
,则吸入肺部CO的浓度不能超过________mol·L-1。
(2)有如下三个与CO相关的反应:
Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=Q1,平衡常数K1
FeO(s)+CO(g) ΔH=Q1,平衡常数K1
Fe(s)+H2O(g) FeO(s)+H2(g) ΔH=Q2,平衡常数为K2
FeO(s)+H2(g) ΔH=Q2,平衡常数为K2
H2(g)+CO2(g) CO(g)+H2O(g) ΔH=Q3,平衡常数为K3
CO(g)+H2O(g) ΔH=Q3,平衡常数为K3
在不同的温度下K1、K2、K3的数值如下:
| T/℃ |
K1 |
K2 |
K3 |
| 700 |
1.47 |
2.38 |
0.62 |
| 900 |
2.15 |
1.67 |
|
请回答下列问题:
①Q1、Q2、Q3的关系式:Q3=________。
②K1、K2、K3的关系式:K3=________,根据此关系式可计算出上表中900 ℃时,K3的数值为________(精确到小数点后两位)。可进一步推断反应H2(g)+CO2(g)CO(g)+H2O(g)为________(填“放”或“吸”)热反应,Q3________0(填“>”、“<”或“=”)。③改变条件使可逆反应H2(g)+CO2(g) CO(g)+H2O(g)已经建立的平衡逆向移动,可采取的措施有________。
CO(g)+H2O(g)已经建立的平衡逆向移动,可采取的措施有________。
A.缩小容器体积 B.降低温度 C.使用催化剂 D.设法增加H2O(g)的量
E.升高温度
(3)在一定条件下,使CO和O2的混合气体13 g充分反应,所得混合气体在常温下与足量的Na2O2固体反应,结果固体增重7 g,则原混合气体中CO的质量是________g。
(10分)(1)在KCl和CaCl2的混合物中,K+和Ca2+的物质的量之比为2:1,则KCl和CaCl2的物质的量之比为,若要取出含1mol Cl-的该混合物,应称取该混合物的质量为g。
(2)同温、同压下某瓶充满O2时重106克,充满CO2时重112克,充满某气体时重98克。则某气体的相对分子质量为。
(3)铜和浓硫酸发生反应的化学方程式为:Cu +2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
在该反应中,若消耗了32 g Cu,则转移了_ __mol 电子 ,生成 _ _L SO2(标准状况)气体。
向100mL0.1mol/L硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol/L Ba(OH)2溶液.随着Ba(OH)2溶液体积V(横坐标)的变化,沉淀总物质的量n的变化如图所示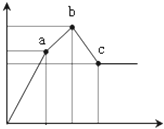
已知铝盐中滴加过量氨水能产生Al(OH)3沉淀,该沉淀遇强碱如NaOH溶液又可溶解。请回答下列问题:
(1)写出b﹣c发生反应的离子方程式:;
(2)下列说法正确的是
| A.a点的溶质为(NH4)2SO4 |
| B.b点溶液中一定存在:c(NH4+)+c(H+)=c(OH﹣) |
| C.b点沉淀为Al(OH)3和BaSO4 |
| D.C点溶液中一定存在:c(AlO2﹣)>c(Ba2+)>c(NH4+) |
(3)写出a﹣b发生反应的离子方程式:;
(4)滴加到c点共加入Ba(OH)2溶液的体积为mL,b、a两点沉淀的质量差为g(精确到0.001).
将Na2O2和NaHCO3的混合物粉末分为两等份,其中一份加入100mL盐酸,充分反应后溶液为中性,放出气(已干燥)2.24L(标准状况),将生成的气体全部通入另一份混合粉末,充分反应后气体的体积变为2.016L(标准状况),问:
(1)2.24L气体的成分为:;
(2)试通过讨论并计算每份混合粉末中Na2O2和NaHCO3的物质的量:
第一种情况:n(Na2O2)=mol和n(NaHCO3)=mol;
第二种情况:n(Na2O2)=mol和n(NaHCO3)=mol.
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
阳离子:K+ Na+Cu2+Al3+
阴离子:SO42-HCO3- OH-Cl-
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸酸化的硝酸钡溶液,只有A中放出无色气体,只有D中产生白色沉淀;
⑤将B、C两溶液混合,未见沉淀或气体生成。根据上述实验填空:
(1)写出B、D的化学式:B____,D。
(2)C可用作净水剂,用离子方程式表示其净水原理_______。
(3)将含0.01 mol A的溶液与含0.02 mol E的溶液反应后,向溶液中滴加0.1 mol·L-1稀盐酸。下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是

(4)在m mL b mol·L-1C溶液中,加入等体积a mol·L-1的E溶液。
当a≤3b时,生成沉淀的物质的量是mol;
当3b<a<4b件时,生成沉淀的物质的量是mol。
以下是有关物质相互转化的关系图,其中A俗称铁红,甲为强酸,乙为还原性气体,丙为强碱溶液,G为红褐色沉淀,I的颜色呈浅绿色。
(1)若F是由Na+和SO42-组成的溶液,则甲的化学式是 _____________,列举A物质的一种用途______________________________________________________________。
(2)若D是能使澄清石灰水变浑浊的气体,则乙的化学式为________,丁属于单质、酸、碱中的________;在I溶液中加入氢氧化钠溶液,可以观察到的现象是______________________________,
对应的离子方程式和化学方程式依次是______________________,___________________。
(3)写出G→A+C的化学方程式: ___________________________________。
(4)写出E和C反应的方程式并用单线桥法标明电子的转移方向和数目:__________。
(5)若A中混有杂质Al2O3,除去杂质的方法是加入过量的________,该反应的离子方程式为__________。
(6)由E和A组成的混合物与稀H2SO4作用,固体恰好溶解,所得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为4∶1。则反应物中A、E、H2SO4的物质的量之比为________。