Ⅰ.下列化合物中,含有非极性共价键的离子化合物是 ( )。
| A.CaC2 | B.N2H4 | C.Na2S2 | D.NH4NO3 |
Ⅱ.图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞如图B所示。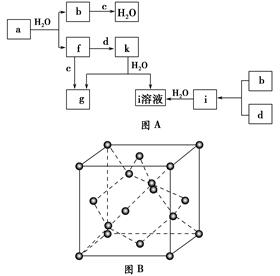
回答下列问题:
(1)图B对应的物质名称是________,其晶胞中的原子数为________,晶体类型为________。
(2)d中元素的原子核外电子排布式为________。
(3)图A中由二种元素组成的物质中,沸点最高的是________,原因是________________________________________________________________________,该物质的分子构型为________,中心原子的杂化轨道类型为________。
(4)图A中的双原子分子中,极性最大的分子是________。
(5)k的分子式为________,中心原子的杂化轨道类型为________,属于________分子(填“极性”或“非极性”)。
现有如下两个反应:
A.NaOH + HCl=NaCl + H2O
B.2FeCl3+Cu=2FeCl2+CuCl2
(1)根据两反应本质, 判断能否设计成原电池:A。_______, B。________(选择“能”或“不能”);
(2)如果不能, 说明其原因_____________________________________;
(3)如果可以, 则写出正、负极材料及其电极反应式, 电解质溶液名称:
负极材料________,电极反应式_______________,电解质溶液名称____________,
正极材料________,电极反应式_______________。
(10分)(1)请选择合适方法的字母代号填空:
①从海水中提取粗盐________;② 煤转化为焦炭、煤焦油等________;
③ 工业上由氧化铝制取金属铝________;④ 提纯氢氧化铁胶体________。
A.过滤 B.裂解 C.分馏 D.裂化 E.干馏 F.还原
G.电解 H.溶解 I.渗析 J.蒸发 K.氧化
(2)某可逆反应从0—2分钟进行过程中, 在不同反应时间各物质的量的变化情况如右图所示。则该反应的的反应物是,生成物是,此反应(填是或不是)可逆反应;反应开始至2分钟时, _____(能或不能)用C表示反应速率,2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了 ____状态,此时正反应速率逆反应速率(填等于或不等于)。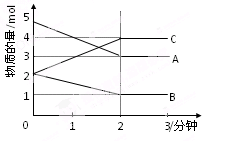
已知:①R—C≡N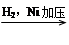 RCH2NH2
RCH2NH2
②R—CN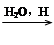 RCOOH,
RCOOH,
③R—Cl+CN- R—CN+Cl-(R为烃基)。
R—CN+Cl-(R为烃基)。
玉米芯、甘蔗渣等废物水解发酵后可制得糠醛 ,它是重要的化工原料,它在一定条件下可发生以下变化:
,它是重要的化工原料,它在一定条件下可发生以下变化:
(1)写出反应类型:②___________________,④___________________。
(2)写出反应③的化学方程式:______________________________________;
(3)写出能证明糠醛中含有醛基的一个化学反应方程式_________________________。
若E为高聚物,则其结构简式 ______________________________________。
若E为环状化合物,则其结构简式______________________________________。
(4)糠醛也能与苯酚在一定条件下发生反应生成高分子化合物,原理与甲醛苯酚反应原理相同,试写出糠醛与苯酚的化学反应方程式。
含苯酚的工业废水处理流程图如下所示: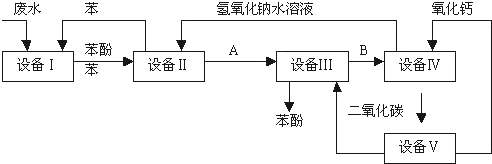
(1)上述流程里,设备Ⅰ中进行的是(填操作名称)操作,实验室里这一步操作可以用(填仪器名称)进行。
(2)由设备Ⅱ进入设备Ⅲ的物质A是,由设备Ⅲ进入设备Ⅳ的物质B是。
(3)在设备Ⅲ中发生反应的化学方程式为。
(4)在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和,通过操作(填操作名称)可使产物相互分离。
(5)图中,能循环使用的物质是C6H6、CaO、。
塑化剂是工业上被广泛使用的高分子材料助剂,在塑料加工中添加这种物质,可以使其柔韧性增强,容易加工。塑化剂可合法用于工业生产,但禁止作为食品添加剂。截止2011年6月8日,台湾被检测出含塑化剂食品已达961种,据媒体报道,2012年岁末,我国大陆多种著名品牌白酒也陷入了塑化剂风波。常见塑化剂为邻苯二甲酸酯类物质,某有机物J(C19H20O4)是一种塑料工业中常用的塑化剂,可用下列合成路线合成。

Ⅱ.控制反应条件,使物质A中的支链Y不与NaOH溶液发生反应;
Ⅲ.F与浓溴水混合不产生白色沉淀。请回答下列问题:
(1)E中官能团的名称为_____________;F中官能团的电子式为_____________。
(2)写出A+F→ J的化学反应方程式________________________________。
(3)写出下列化学反应类型:反应①___________________;反应④________________。
(4)写出F的含苯环的所有同分异构体的结构简式:__________________________。
(5)以含碳原子数不同的苯的同系物为原料,可以合成不同种类的塑化剂。教材中苯及其同系物的通式是CnH2n-6(n≥6),某同学根据等差数列公式推导出该系列的通式却是Cn+5H2n+4,老师告诉该同学他推导出的通式也是正确的,但其中n的意义和取值范围与教材中的通式不同,请问:通式Cn+5H2n+4中n的意义是_______________________________,其取值范围是______________。