2012年12月,我国成功实现歼—15飞机在“辽宁号”航母上的起降实验,建造航母平台和舰载飞机离不开如钛、物质A等材料。请回答下列问题:
(1)写出钛基态原子的核外电子排布式:___________________________。
(2)已知元素A处于第3周期,其原子的第一至第四电离能数据如表所示:
| 电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
| A |
738 |
1 451 |
7 733 |
10 540 |
①A的元素符号为________。
②与元素A同周期的电负性最大的元素为________(填元素符号),该元素能与同周期的另一种非金属元素形成5原子分子,该分子的中心原子采用的杂化方式是________,该分子的空间构型为________。
(3)钛镁合金是制造高性能飞机的重要材料。已知钛、镁金属均采用六方最密堆积( ),下列说法正确的是________(填序号)。
),下列说法正确的是________(填序号)。
A.用钛镁合金来制造高性能飞机,主要由于其价格昂贵,制造出的飞机能卖个好价钱
B.在高温下切割金属钛不会产生任何安全事故
C.钛、镁金属晶体中,其配位数均为12
D.金属钛的熔点很高(1 668 ℃),与金属键关系不大
(4)钙钛型复合氧化物(如图所示)可用于制造航空母舰中的热敏传感器,该晶体以A原子为晶胞的顶点,A可以是Ca、Sr、Ba或Pb,当B是V、Cr、Mn或Fe时,这种化合物具有很好的电化学性能。用A、B、O表示钙钛型复合氧化物晶体的化学式为________。
某同学设计了如下图所示装置(部分夹持装置已略去)进行实验研究。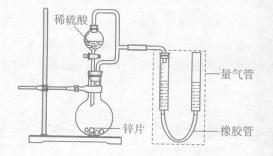
请回答:
(1)用上述装置探究影响化学反应速率的因素。
①圆底烧瓶中发生反应的离子方程式是。
②用上述装置进行实验,以生成9.0 mL气体为计时终点,结果为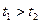 。
。
| 序号 |
V(H2SO4)/mL |
C(H2SO4)/mol·L-1 |
t/s |
| I |
40 |
1 |
t1 |
| II |
40 |
4 |
t2 |
比较实验I和Ⅱ可以得出的实验结论是。
实验过程中,对量气管的操作是。
③若将锌片换成含杂质的粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验对应的数据。粗锌片中所含杂质可能是(填序号)。
A.石墨 b.银 c.铜d.沙粒(二氧化硅)
(2)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀。
①圆底烧瓶中的试剂可选用(填序号)。
a.NaOH溶液 b.C2H5OH c.NaCl溶液 d.稀硫酸
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是。
X、Y、Z、L、M五种短周期元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,其中X是原子半径最小的元素,L是地壳中含量最高的元素。M是地壳中含量最高的金属元素。回答下列问题:⑴Z的单质一个分子中含有____个π键; M的原子结构示意图为_______________
(2)五种元素原子半径从大到小的顺序是________________________(用元素符号表示)
(3) Y、Z、L三种元素第一电离能由大到小的顺序是______________(用元素符号表示)
(4) Z、X两元素按原子数目比l∶3和2∶4分别构成分子A和B,A分子空间构型为___________,A分子 中Z原子的轨道杂化方式为_______,B的结构式为______________。
中Z原子的轨道杂化方式为_______,B的结构式为______________。
(5) 硒(se)是人体必需的微量元素 ,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为________,其最高价氧化物对应的水化物化学式为_____________。
,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为________,其最高价氧化物对应的水化物化学式为_____________。
该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 mol·L-1 b.+29.7  mol·L-1 c.-20.6 mol·L-1 d.-241.8 kJ·mol-1
mol·L-1 c.-20.6 mol·L-1 d.-241.8 kJ·mol-1
X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y |
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z |
Z和Y同周期,Z的电负性大于Y |
| W |
W的一种核素的质量数为63,中子数为34 |
(1)X的最高价氧化物固态时俗称“ ”,属于 晶体。该分子的空间构型是 。
(2)Y的价层电子(外围电子)排布式为 ,Y和Z的最高价氧化物对应的水化物的酸性较强的是 (写化学式)。
(3)XY2是一种常用的溶剂,XY2的分子 中存在 个σ键,属于 (填“极性”或“非极性
中存在 个σ键,属于 (填“极性”或“非极性 ”分子。
”分子。
(4)在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(5)W的基态原子核外电子排布式是 。在W的二价硫酸盐溶液中通入过量的氨气,小心蒸发,最终得到的[W(NH3 )4]SO4晶体中含有的化学键除了极性共价键外,还有 和 。
)4]SO4晶体中含有的化学键除了极性共价键外,还有 和 。
胃舒平主要成分是氢氧化铝,同时含有三硅镁(Mg2Si3O8`H2O)等化合物。
(1)比较铝离子和镁离子半径大小(用离子符号表示)______________________。
(2)比较铝和镁的第一电离能大小__________________(用元素符号表示)
(3)下列事实不能说明镁比铝的金属性强的是____________
A.Al(OH)3可溶于强碱溶液中,M g(OH)2不能 g(OH)2不能 |
| B.Mg能从铝盐溶液中置换出铝 |
| C.Mg 原子最外层只有2个电子, 而Al原子最外层有3个电子 |
| D.Mg与盐酸反应比铝与盐酸反应更剧烈 |
(4)已知:电负性: Mg- 1.2 Al- 1.5 Cl-3.0 。则MgCl2晶体中存在的作用力是__________;AlBr3属于_________(填“离子”或“共价”)化合物
(5)某元素与镁元素不同周期但在相邻主族,且性质和镁元素性质十分相似,该元素符号是___________,原子核外电子排布式为_____________________。
(6) Al2O3、MgO都有很高的熔 点,都可以制耐火材料,其原因是_____________________
点,都可以制耐火材料,其原因是_____________________
______________________________________________________________________________
硅是一种重要的非金属 单质,硅及其化合物的用途非常广泛。根据所学知识回答硅及其化合物的相关问题。
单质,硅及其化合物的用途非常广泛。根据所学知识回答硅及其化合物的相关问题。
(1)基态硅原子的核外电子排布式为。
(2)晶体硅的微观结构与金刚石相似,晶体硅中Si-Si键之间的夹角大小约为______。
(3)下面关于SiO2晶体网状结构的叙述正确的是
A..最小的环上,有3个Si原子和3个O原子
B.最小的环上,有6个Si原子和6个O原子
C.存在四面体结构单元,O处于中心,Si处于4个顶角
(4)下表列有三种含硅物质(晶体)的熔点:
| 物质 |
SiO2 |
SiCl4 |
SiF4 |
| 熔点/℃ |
1610 |
-69 |
-90 |
简要解释熔点差异的原因:
①SiO2和SiCl4:_________________________________________;
② SiCl4和SiF4:_________________________________________
(5)“神七”字 航员所穿出仓航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由一种由硅及其同主族相邻短周期元素形成的化合物和碳纤维等复合而成的,它是一种新型无机非金属材料。该化合物的化学式为:________。已知该化合物的硬度仅次于金刚石,熔点比SiO2高,该化合物晶体属于________晶体[填“分子”、“原子”或“离子”。
航员所穿出仓航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由一种由硅及其同主族相邻短周期元素形成的化合物和碳纤维等复合而成的,它是一种新型无机非金属材料。该化合物的化学式为:________。已知该化合物的硬度仅次于金刚石,熔点比SiO2高,该化合物晶体属于________晶体[填“分子”、“原子”或“离子”。